|
|
|
|

elle s'exprime en mol m-3 s-1
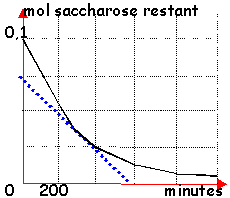
durée au bout de laquelle l'avancement x est égal à la moitié de l'avancement final xf.
les facteurs cinétiques agissent sur la vitesse
la vitesse d'une réaction augmente avec la température
un catalyseur accèlère une réaction chimique; il n'apparaît pas dans le bilan.
. .
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
L'eau oxygénée H2O2 intervient dans deux couples redox H2O2/H2O (+1,77 V) et O2/H2O2 (0,68 V) .Dans l'eau oxygénée, on verse quelques gouttes d'une solution aqueuse de chlorure de fer(III) : on constate un dégagement gazeux de dioxygène. (répondre vrai ou faux)
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
vrai les ions fer(IIi) sont dans la solution d'eau oxygénée. Le métal platine réaliserait une catalyse hétérogène. vrai Un catalyseur accèlère la réaction; il est régénéré à la fin et n'intervient pas dans le bilan vrai Qté de matière du gaz O2 :0,3 / 24 = 0,0125 mol vitesse moyenne de formation O2 :0,0125 / 30 4,2 10-4 mol min-1 |
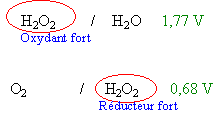 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
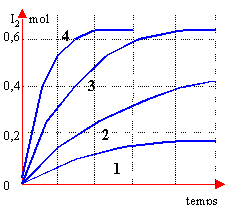
On réalise l'expérience dans différentes conditions
|
 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
c correspond à 3 a correspond à 2 d correspond à 1 faux les courbes 1 et 2 correspondent à la question (température identique et pas de catalyseur) . Les durées au bout desquelles la moitié des réactifs initiaux ont disparus sont différents d'après les graphes.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
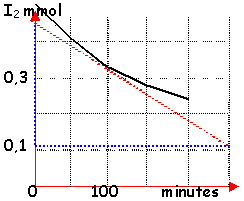
L'action lente des ions peroxodisulfate(S2O82-) sur les ions iodures (I-), en présence ou non d'ions Fer(III), s'effectue selon l'équation bilan suivante : Pour étudier la cinétique de cette réaction (1) la concentration du diiode I2 est déterminée grâce à un dosage rapide par une solution de thiosulfate (S2O32-) de concentration C1= 0,01 mol.L-1 selon l'équation suivante :
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
masse molaire: 23*2+64+48+5*18=248 gmol-1. Qté de matière (mol)=concentration(mol L-1)*volume(L)=0,5*0,25=0,125 mol masse des cristaux=
Qté de matière
(mol)*masse
molairegmol-1=0,125*248=
31g
placer dans fiole jaugée de 500 mL complétée à l'eau distilée volume pipette(L) *[solution départ](mol L-1)=volume fiole(L) *[solution finale](mol L-1) V=0,5*0,01/0,5=10
mL
diiode: V0[I2] thiosulfate V1C1 d'après l'équation bilan (2) : V1C1= 2*V0[I2] |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
masse molaire =342g mol-1. masse (g)
/ masse molaire
(gmol-1) =
34,2/342 =
0,1 mol dans
0,1 L
0,0625 0,031 0,075 / 600=
1,25
10-4 mol
minute-1. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
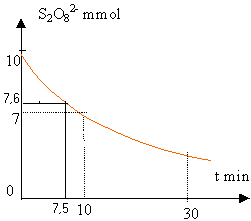
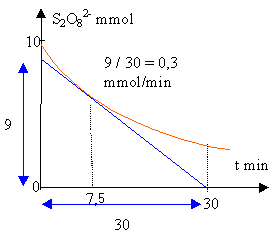
On étudie la décomposition de l'eau oxygénée: 2 H2O2 donne 2 H2O + O2 à t=0, on a dans la solution 0,06 mol de H2O2 et le volume est 1 L. On mesure le volume V de dioxygène formé.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
V/Vm La quantité de matière (mol) d'eau oxygénée disparue : est deux fois plus grande que la quantité de O2 formé. (voir coef de l'équation bilan) : 2 V/Vm est égale à la quantité initiale moins ce qui reste : 0,06-c 2 V/Vm = 0,06-c donc c=0,06-2 V/Vm |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
On porte à 350°C quatre ballons de 1L:A,B,C et Drenfermant chacun 0,50 mmol de H2. Les ballons sont maintenus à cette température durant des durées différentes,puis ils sont brutalement refroidis. Le diiode restant dans chaque ballon est d'abord dissous dans une solution d'iodure de potassium(qui prend une couleur jaune),puis il est dosé par une solution de thiosulfate de sodium de formule Na2S2O3 et de concentration molaire C=0,050mol.L-1.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Le diiode constitue l'oxydant fort et l'ion thiosulfate le réducteur fort I2 +
2
S2O32-
donnent
2
I- + S4O62-
0,83 0,685 0,57 0,47 ayant
réagi 0,415 0,34 0,285 0,235 0,34 / 250=
1,3
10-3 mmol
minute-1. la vitese de
formation de HI est 2 fois plus grande
(voir coef.
équation) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||