|
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
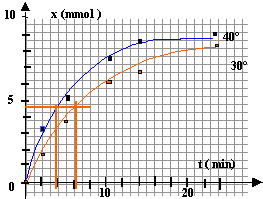
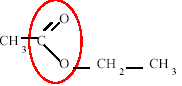
Le chlorure de tertiobutyle (CH3)3C-Cl peut réagir avec l'eau : (CH3)3C-Cl +H2O--> H+(aq) + Cl-(aq)+(CH3)3C-OH Par la suite (CH3)3C-Cl sera noté R-Cl et (CH3)3C-OH sera noté R-OH. Dans deux béchers différents on introduit 30 g d'eau et 20 g d'acétone. L'un des béchers est maintenu à 40°C, l'autre à 30°C. Quand l'équilibre thermique est atteint on plonge la sonde du conductimètre dans l'un des béchers et on met en route l'agitation. On ajoute alors 1 mL de tertiobutyle et on suit l'évolution de la conductivité s en fonction du temps. On fait de même avec l'autre bécher. 
pour R-Cl : masse molaire = 92,6 g/mol ; densité d= 0,85.
masse (g) = densité * volume(mL) = 0,85*1 = 0,85 g n0 = 0,85 / 92,6 = 9,18 10-3 = 9,18 mmol.
9,18-xmax =0 donne xmax = 9,18 mmol Les ions chlorures Cl- et les ions H+ sont responsables de l'évolution de la conductivité s. s = (lH+ + l Cl-) c lH+ et l Cl- conductivité molaire ionique ( S m²/mol) c concentration H+ en mol/m3. s conductivité en S /m. au bout d'un temps très long, la réaction est terminée : celle ci étant totale l'avancement final est égal à l'avancement maximal et c = xmax / V = n0 / V s infini = (lH+ + l Cl-) n0 / V de même : s t= (lH+ + l Cl-) x / V s t / s infini = x /n0 d'où x = n0 s t / s infini. à 30°C :
la température est un facteur cinétique : plus la température est élevée plus la durée de la transformation est courte. d'où la position de la courbe bleue. Ces deux courbes, issues de mesures expérimentales, admettent à peu près la même limite à savoir xmax voisin de n0 =9,18 mmol. le temps de demi réaction est le temps au bout duquel x = ½ x final. à 30°C : t½ = 6 min et à 40°C t½ = 4 min.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Le but de cet exercice est d'étudier la cinétique de l'hydrolyse basique d'un ester E par suivi conductimétrique À cette fin, on mélange rapidement dans un bécher une quantité n1 = 0,01 mol de soude et une quantité n2 d'ester E en excès à 25°C. On note VT le volume total du mélange. Conductivités molaires ioniques de quelques ions à 25°C :(S. m². mol-1) lNa+= 5 10-3 ; lCH3COO-= 4,1 10-3 ; lHO-= 20 10-3 ; On négligera la contribution des ions H3O+ à la conductivité de la solution en raison de leur faible concentration. On admettra que le volume VT est suffisant pour pouvoir considérer la conductivité molaire ionique comme constante.
Du point de vue de la conductivité, tout se passe comme si les ions hydroxyde étaient remplacés par les ions éthanoate. Or les ions éthanoate ont une conductivité bien plus faible que les ions hydroxyde. La conductance de la solution diminue donc. G0 = kn1/VT(lHO-+lNa+) = 46,2 mS (lecture tableau) G = k/VT((n1-x)lHO-+n1lNa++ xlCH3COO-) D'après le texte, on sait que le réactif limitant est l'ion hydroxyde et donc qu'il a été entièrement consommé. Il s'est donc formé n1 mol d'ions éthanoate. Gf = kn1/VT(lCH3COO-+lNa+) = 10,7 mS (lecture tableau) G-G0= kx/VT(-lHO-+lCH3COO-) = kx/VT((-lHO--lNa++lCH3COO-+lNa+) k/VT (-lHO--lNa+) = -G0 /n1 ; k/VT(lCH3COO-+lNa+)=Gf /n1 d'où : G-G0= x/n1(Gf-G0) soit x = n1 (G-G0) / (Gf-G0).
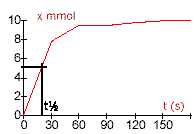
5. 3. La vitesse de réaction suit les variations de la pente de la tangente à la courbe : elle diminue au cours du temps jusqu'à s'annuler lorsque l'avancement maximal est atteint. Le temps de demi-réaction est le temps nécessaire pourqe l'avancement sit parvenu à la moitié de sa valeur finale. Dans une réaction totale, l'avancement final est l'avancement maximal donc ici le temps de demi-réaction est le temps nécessaire pour qu'il ait eu consommation de la moité de matière de soude apportée. Le temps de demi-réaction est donc t1/2 = 20 s.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|