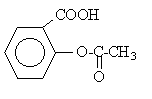
Le comprimé d'aspirine simple est formé par des particules de taille importante d'acide acéthylsalicylique agglomérées par de l'amidon. La forme HA liposoluble est la seule capable de traverser les parois de l'estomac.
Lorsque l'on place un comprimé en milieu aqueux, on obtient une suspension buvable, de consistance désagréable, de la forme acide de l'aspirine qui est très peu soluble dans l'eau.
Au niveau de l'estomac, ces grosses particules ne sont absorbées que très lentement par le système sanguin. Il en résulte une action douloureuse et corrosive de la muqueuse gastrique.
L'élimination de CO2 sous forme de bulles participe à la désagrégation du comprimé mais provoque le déplacement de l'équilibre vers la formation de A-. La solution aqueuse est homogène et son pH est voisin de 6. Dans l'estomac (milieu de pH voisin de 1) les ions A- vont se transformer en molécules HA.
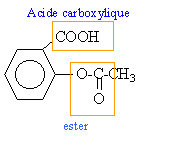
- Encadrer et nommer les 2 fonctions chimiques de l'aspirine
- En utilisant l'échelle des pKa montrer que
l'équilibre (E)
est déplacé à droite
HA / A- pKa=3,5; CO2, H2O / HCO3- pKa =6,4 - Calculer la constante de cet équilibre. La réaction peut-elle être considérée comme totale ?
- Avec l'aspirine tamponnée effervescente: Pour quelle raison le dégagement de CO2 permet-il la disparition totale de la forme HA ? Pour quelle raison la solution aqueuse ne contient pas de particules solides ?
- Dans l'estomac :
calculer le rapport [HA] / {A-]
à pH=1
- expliquer pourquoi l'aspirine peut "précipiter " sous la forme HA dans l'estomac, en écrivant une équation bilan. - Synthèse:
Pour quelle (s) raison(s) est-il nécessaire que
l'aspirine soit sous forme HA dans l'estomac ?
- Où se situe l'avantage de cette "précipitation" de l'aspirine tamponnée effervescente par rapport à l'aspirine simple. Justifier vos réponses à l'aide du texte.
corrigé
au regard des pKa, l'acide HA est l'acide le plus fort et la base HCO3- est la base la plus forte.
On s'attend donc à une réaction naturelle spontanée, donc la constante K sera grande, l'écart des pKa étant de l'ordre de 3.
K= [CO2][A-] / ([HA] [HCO3-]
réaction naturelle donc : 10 exposant (différence positive des pKa)
K= 10 (6,4-3,5 ) = 10 2,9.
La réaction entre HA et
HCO3-est totale :
- conduisant à la disparition de la forme HA, peu
soluble dans l'eau, au profit de A-, soluble dans
l'eau (disparition des particules solides).
dans l'estomac:
pH = pKa + log ([A-] / [AH])
1 = 3,5 + log ([A-] / [AH])d'où [A-] / [AH]= 10 -2,5= 3,16 10-3.
soit (AH] / [A-] = 316.
les ions A- réagissent avec les ions H3O+ responsables du pH de l'estomac suivant :
A- + H3O+ donne AH + H2O constante K= 10 (0-(-3,5 )) =10 3,5 .réaction totale
avantages :
seule la forme HA, liposoluble et sous forme de particules de petite taille, est susceptible de traverser la paroi de l'estomac.
Par contre lors de la dissolution dans un verre d'eau, seule la forme A-se dissout bien et évite la formation de grosses particules solides. La désagrégation du comprimé solide étant assuée par le dégagement de CO2.