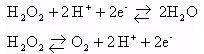| |
eau oxygénée bac 06/01 |
||||||
| |
|
||||||
|
|
H2O2 |
Sur l'étiquette d'une bouteille d'eau oxygénée, on peut lire les indications suivantes :  Données : Masse molaire du peroxyde d'hydrogène : 34 g.mol-1.
- Recopier ces 2 demi-équations et écrire les couples rédox correspondant à chacune d'elles. - A partir de ces demi-équations, retrouver l'équation-bilan de la réaction de dismutation de l'eau oxygénée.
|
|||||
| |
Quantité de matière (mol) = masse (g) divisée par masse molaire (g/mol) 3 / 34 = 0,0882 mol contenu dans 0,1 L de solution. soit 0,882 mol dans 1L ou 0,882 mol/L. Le titre (en volumes) de l'eau oxygénée est le volume de dioxygène (exprimé en litres) que peut libérer 1L de solution dans les conditions normales de température et de pression (où Vm = 22,4 L.mol-1). réaction : H2O2 --> H2O + ½ O2. à une mole d'eau oxygénée correspond ½ mol de dioxygène soit 11,2 L à 0,882 mol correspond : 0,882*11,2 = 9,9 L O2 soit 9,9 volumes. L'étiquette annonçait un titre de "10 volumes" : le résultat est conforme à 1% près . couple oxydant / réducteur associé : H2O2 / H2O couple associé : O2 / H2O2 . En additionnant les 2 demi-équations et en éliminant (2H+) et (2 e-) qui figurent des 2 cotés, on obtient l'équation de dismutation de l'eau oxygénée : 2 H2O2 donne 2 H2O + O2.
|
||||||
|
|
|