|
masse molaire de l'acide lactique : 90 g/mol
couples acide base de l'eau H2O /
HO- : pKa = 14 ; H3O+ /
H2O pKa = 0.
Sous l'action de ferments lactiques , le lactose du lait
se transforme progressivement en acide lactique
CH3-CHOH-COOH.
- Ecrire la formule semi-développée de
cet acide, puis encadrer et nommer les groupes
fonctionnels présents dans la
molécule.
- La molécule est-elle chirale ? Justifier la
réponse. Dans l'affirmative représenter
dans l'espace les deux énantiomères.
- Moins le lait est frais, plus il contient d'acide
lactique. On se propose de doser l'acide lactique
présent dans un lait qui n'a subit aucun
traitement, par une solution aqueuse d'hydroxyde de
sodium ( soude) de concentration Cb=0,05
mol/L. On verse un volume Va = 20 mL de lait
frais dans un bécher et on suit l'évolution
du pH lors d'une addition progressive de solution de
soude.
|
V soude (mL
|
0
|
2
|
4
|
6
|
8
|
10
|
11
|
11,5
|
12
|
12,5
|
13
|
14
|
16
|
|
pH
|
2,9
|
3,2
|
3,6
|
3,9
|
4,2
|
4,6
|
4,9
|
6,3
|
8
|
10,7
|
11
|
11,3
|
11,5
|
- Quelle verrerie faut-il utiliser pour mesurer les 20
mL de lait et pour additionner progressivement la
solution de soude ?
- Tracer sur une feuille de papier
millimétré le graphe de la variation du pH
en fonction du volume de soude ajouté. On adoptera
l'échelle suivante : 1 cm correspondant à 1
mL en abscisse, 1 cm correspondant à une
unité de pH en ordonnée.
- En déduire par une construction graphique
d'usage les coordonnées du point
d'équivalence, la valeur du pKa de l'acide
lactique.
- Ecrire l'équation bilan de la réaction
qui se produit lors du mélange de la solution
d'acide lactique et de la soude.
- Calculer la constante Kr de cette réaction.
cette réaction peut-elle être
considérée comme totale ? Justifier.
- Calculer la masse d'acide lactique dans un litre de
lait.
- Dans l'industrie alimentaire, l'acidité du
lait s'exprime en degré Dornic, noté
°D. Un degré Dornic correspond à
l'acidité qu'apporterait la présence de 0,1
g d'acide lactique dans un litre de lait. Un lait frais
à une acidité comprise entre 15 et
18°D. Le lait étudié peut-il
être considéré comme frais ?
corrigé
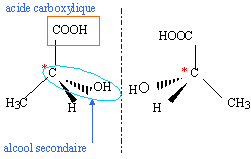
la
molécule possède un carbone asymétrique
( carbone tétragonal lié à 4 groupes
d'atomes différents) ; la molécule est
chirale, non superposable à son image dans un miroir.
les 20 mL de lait sont prélevés
à l'aide d'une pipette graduée + pipeteur.
la solution de soude est ajoutée progressivement
à l'aide d'une burette graduée.
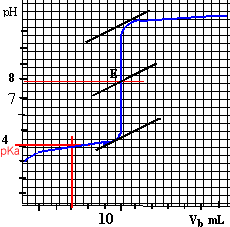
le point d'équivalence est déterminé
par la méthode des tangentes ( E : pH=8 ;
Véqui = 12 mL)
à la demi-équivalence d'un dosage acide
faible-base forte, le pH est égal au pka du couple
acide / base : pKa voisin de 4.
CH3-CHOH-COOH + HO- -->
CH3-CHOH-COO- + H2O
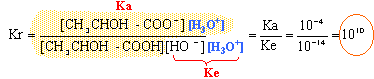
la constante Kr est grande, alors la réaction est
totale.
A l'équivalence les quantités de
réactifs mis en présence sont dans les
proportions stoéchiomètriques.
CaVa= CbVb = 0,05*12 = 0,6 mmol d'acide dans 20 mL de
lait
soit [acide lactique] = 0,6 / 20 = 0,03 mol/L
masse d'acide lactique par litre de lait : 0,03*90 = 2,7
g ou 27°D.
le lait n'est pas frais
retour
- menu
|


