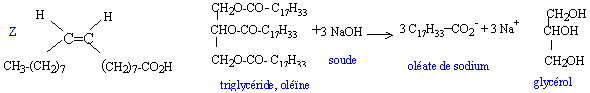|
( concours sage femme) (sans calculatrice) |
|||
|
|||
|
masse molaire de l'oléine : 884 g/mol ; de l'oléate de sodium 384 g/mol ; de l'hydroxyde de sodium : 40 g/mol ; du glycérol 92 g/mol. partie I : L'huile d'olive contient principalement de l'oléine qui est le triester du glycérol et de l'acide oléique.
partie II : préparation du savon Introduire 10 g d'oléine pure dans un réacteur de 100 mL surmonté d'un réfrigérant droit et équipé d'un agitateur. Ajouter ensuite une solution obtenue en dissolvant 10 g d'hydroxyde de sodium dans 35 mL d'un mélange à volume égaux d'eau et d'éthanol. Agiter et chauffer à reflux pendant 45 min. Verser rapidement le mélange réactionnel chaud dans une solution concentrée de chlorure de sodium. Agiter le tout pendant 5 min et laisser reposer. Filtrer sur büchner en versant d'abord le plus possible de liquide. Laver à l'eau glacée et sécher. Le produit sec obtenu a une masse de 9,8 g.
la réaction entre le triester et la soude est une réaction de saponification, lente et totale. la partie hydrophile de l'oléate de sodium est le groupe -COO-: ce dernier s'entoure facilement de molécules d'eau. la partie hydrophobe de cet ion oléate est la longue chaîne carbonée C17H33- : cette partie n'interagit pas avec les molécules d'eau. On surmonte le réacteur d'un réfrigérant afin de condenser les vapeurs : celles ci retombent dans le réacteur; il n'y a pas de pertes de matière. relargage : le savon insoluble dans l'eau salée concentrée précipite. Qté de matière théorique d'oléate de sodium = 3 fois Qté de matière d'oléine = 3 * 10*884 =0,034 mol masse théorique d'oléate de sodium ( savon) = 0,034*384 = 13 g. rendement = masse réelle / masse théorique = 9,8 / 13 = 0,75 (75 %)
|
|||
|
On donne les formules semi-développées des molécules suivantes : 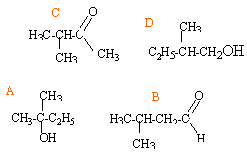
corrigé A : 2- méthylbutan-2-ol ( alcool secondaire) B : 3-méthylbutanal ( aldehyde) C : 3-méthylbutan-2-one ( cétone) D : 2- méthylbutan-1-ol ( alcool primaire) B et C : isomères de fonction A et D :
isomères de position de la fonction alcool.
|