Propriétés et structure de la glace.
1. Donner la représentation de Lewis de la molécule d'eau..
2. Donner la géométrie de la molécule d'eau et la représenter.
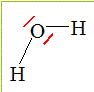 3.
3. Expliquer pourquoi la liaison O-H est polarisée. En déduire si la molécule d'eau est polaire ou non.
L'atome d'oxygène étant plus électronégatif que l'atome d'hydrogène, la
liaison O-H est polarisée. ( charge partielle négative sur l'oxygène).
Le barycentre des charges négatives ne coincide pas avec celui des charges positives . La molécule d'eau est polaire.
On donne la structure cristalline de la glace.
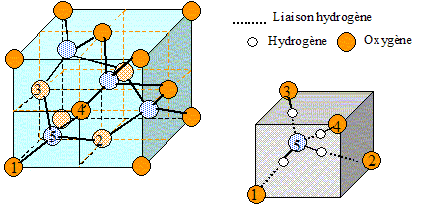
Le paramètre de la maille (côté du cube) vaut a = 635,8 pm.
5. Justifier que cette maille contient en propre 8 atomes d'oxygène.
Chaque atome situé à un sommet compte pour
1/8 ( 8 sommets donc 1 atome) ;
chaque atome située au centre d'une face compte
pour 1/2 ( 6 faces soit 3 atomes) ;
chaque atome située dans un site
tétraètrique compte pour 1 ( soit 4 atomes).
Total : 8 atomes d'oxygène par maille.
6. En déduire la masse volumique de cette glace.
Volume de la maille V = a3 =(635,8 10-12)3=2,57 10-28 m3.
Masse d'une molécule d'eau : M(H2O) / NA =18 10-3 / (6,02 1023) =2,99 10-26 kg.
Masse de 8 molécules d'eau : m =2,39 10-25 kg.
Masse volumique de cette glace m / V = 2,39 10-25 / (2,57 10-28 )= 930 kg m-3.
Les conséquences du réchauffement climatique.
Equation de la réaction de la dissolution du dioxyde de carbone dans l'eau :
CO
2(g) = CO
2aq. K = [
CO2aq] P° / (C° P
CO2) =3,37 10
-2 à 298 K.
PCO2 =360 µbar pression partielle du dioxyde de carbone dans l'atmosphère. P° = 1 bar.
CO2aq. est un acide faible.
CO2 aq + H2O(l) = HCO3-aq + H3O+aq Ka1 = 5,012 10-7.
HCO3-aq est un acide faible :
HCO3-aq + H2O(l) = CO32-aq + H3O+aq Ka2 = 5,012 10-11.
7. Préciser les conséquences sur le cycle du carbone dues au réchauffement climatique.
Réduction de l'épaisseur et de la couverture des glaces.
Acidification de l'eau de mer.
8. Proposer une qualification de l'ion hydrogénocarbonate.
Cet ion peut se comporter comme un acide ou comme une base . Il est amphotère.
9. Rappeler la
relation entre le pH d'une solution aqueuse, la concentration en ion
oxonium et la concentration standard C° = 1 mol / L.
pH = - log ([
H3O+aq] / C°).
10. Exprimer le pH en fonction de
Ka1, [
CO2 aq], [
HCO3-aq].
Ka1 = [HCO3-aq ] [H3O+aq ] / [CO2 aq ]
[H3O+aq ] =Ka1 [CO2 aq ] / [HCO3-aq ].
log[H3O+aq ] =log Ka1+log( [CO2 aq ] / [HCO3-aq ])
- log[H3O+aq ] = -log Ka1-log( [CO2 aq ] / [HCO3-aq ])
pH = pKa1 +log( [HCO3-aq ] / [CO2 aq ] )
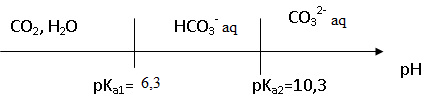
11. Donner le diagramme de prédominance des espèces
CO2 aq, HCO3-aq, CO32-aq en fonction du pH.
pKa1 = -log(5,012 10-7)~6,3 ; pKa2 = -log(5,012 10-11)~10,3.
.
12. Prévoir qualitativement l'effet de la dissolution du dioxyde de carbone sur le pH des eaux de surface océaniques.
Acidification
des eaux de surface océaniques.
13. Expliquer quelle espèce est minoritaire lorsqu'on met du dioxyde de carbone en présence d'eau pure initialement neutre.
A pH = 7 < pKa2, CO32-aq est minoritaire.
14. Citer les propriétés d'une solution tampon.
Une solution tampon modère les variations de pH lors de l'ajout modéré d'un acide ou d'une base, lors d'une dilution modérée.
15. Donner l'expression de la quantité totale de carbone inorganique C
t en fonction de K, K
a1, K
a2, P
CO2 et de [
H3O+aq].
Interpréter la courbe ci-dessous.
C
t =
[CO2 aq ] + [HCO3-aq ] +[CO32-aq].
Ct = [CO2 aq ] {1+ [HCO3-aq ] / [CO2 aq ]+[CO32-aq] / [CO2 aq ] }.
Ka1 = [HCO3-aq ] [H3O+aq ] / [CO2 aq ] soit [HCO3-aq ] / [CO2 aq ] =Ka1 / [H3O+aq ]
Ka2 = [CO32-aq ] [H3O+aq ] / [HCO3-aq ].
Ka1 Ka2 = [CO32-aq ][H3O+aq ]2 / [CO2 aq ] soit [CO32-aq] / [CO2 aq ] =Ka1 Ka2 / [H3O+aq ]2.
K = [CO2aq] P° / (C° PCO2).
Ct =K / (C° PCO2) [ 1 + Ka1 / [H3O+aq ] + Ka1 Ka2 / [H3O+aq ]2 ].
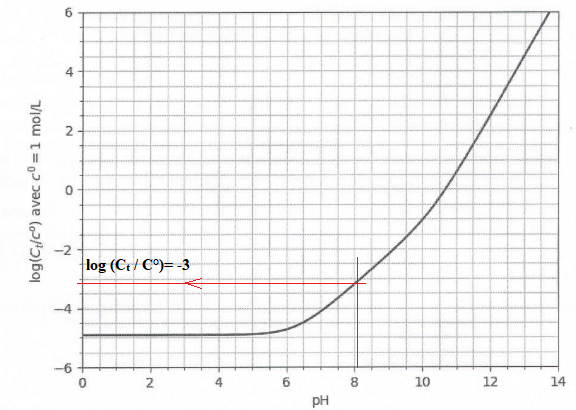
Courbe log (C
t) en fonction du pH pour
PCO2 =360 µbar.
Si [H3O+aq ] augmente, le pH diminue et Ct diminue àPCO2 =constante.
16. Préciser dans quel domaine de pH la quantité totale de carbone inorganique est la plus grande. Conclure.
Plus le pH est grand, plus C
t est grand.
A pH plus faible les eaux de surface stockent moins de carbone inorganique.
17. Quelles conséquences peut avoir sur la biodiversité la diminution du pH des eaux de surface des océans.
Moins le plancton se développe et moins il produit d'oxygène.
En milieu acide, les coraux peuvent difficilement développer leur
squelette calcaire. Leur dégradation affecte le décli de tout un
écosystème, poissons, algues, crustacés liés à ces récifs.
18.
On prélève un litre d'eau de mer. Une mesure du pH donne pH = 8,1.
Estimer la valeur de la masse totale de carbone inorganique contenue
dans ce volume d'eau de mer.
Le graphe indique log( C
t/C° )= -3.
Ct= 10-3 mol / L.
 Suivi satellitaire
Suivi satellitaire


