En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
|||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||
|
Texte : la législation autorise l'addition de 5 % ( en volume) d'éthanol à l'essence. Va=20 mL de ce carburant sont oxydés par une solution acidifiée de permanganate de potassium C= 0, 4mol/L .Véquivalent = 24 mL. réthanaol = 790 kg m-3. C : 12 ; H : 1 ; O : 16 g/mol Couples Ox/red : CH3COOH/CH3CH2OH et MnO4-/Mn2+. Questions traitant de la quantité de matière d'alcool exprimée en mole, en gramme ou en mL. Analyse : Il faut écrire les demi-équations électroniques puis l'équation bilan. 5 fois { CH3CH2OH +H2O = 4H+ + 4e- + CH3COOH } 4 fois { MnO4- + 8H+ + 5e- = Mn2+ + 4 H2O } 5 CH3CH2OH + 4 MnO4- + 12H+ = 5 CH3COOH + 4 Mn2+ + 11 H2O . d'où à l'équivalence : n(alcool) = 5/4 n( MnO4- ) = 1,25 n( MnO4- ). Une quantité de matière (mol) est égal au volume (L) multipliée par la concentration (mol/L) n(MnO4-) =C Véquivalent =0,4* 24 10-3 = 9,6 10-3 mol. n(alcool) = 1,25 * 9,6 10-3 = 0,012 mol ; n(alcool) = 12 mmol. Une concentration (mol/L) est une quantité de matière (mol) divisée par un volume (L). [alcool] = n(alcool) / Va = 0,012/0,020 = 12/20 ; [alcool] = 0,6 mol/L. Masse (g) d'alcool dans 1 L = quantité de matière (mol) * masse molaire (g/mol) M = 12*2+6+16 = 46 g/mol ; m(alcool) = 0,6*46 = 27,6 g dans 1 L. volume ( mL) = masse ( g) divisée par la masse volumique ( g/mL). 790 kg m-3 = 790 *103 / 106 g/cm3 = 0,79 g/cm3 = 0,79 g/mL. 1 mL a une masse de 0,79 g V mL ont une masse de 27,6 g d'où le volume d'alcool : 27,6 / 0,79 = 35 mL dans 1 L de carburant pourcentage volumique : 35/1000 *100 = 3,5 %. a) exact : après l'équivalence l'ion permanganate de couleur violette est en excès. Seules les affirmations contenant l'une des informations suivantes sont donc exactes :
Seul l'ion permanganate
MnO4-
est coloré ( violet assez
foncé) La burette contient la solution de permanganate
de potassium ; l'erlenmeyer ou le becher contient
la solution avec l'éthanol. Avant l'équivalence :
MnO4-
est en défaut dans le becher, la solution
est donc incolore. A l'équivalence :
MnO4-
ajouté est en quantité
stoechiomètrique, la solution est
incolore. Après l'équivalence
: MnO4-
est en excès dans le becher, la solution est
donc rose violet. Seule l' affirmation
suivante est donc exacte : En ajoutant une goutte de
solution de permanganate après
l'équivalence, la couleur de la solution
change.
Ion manganate MnO42- et ion permanganate MnO4-. Texte : une solution, notée A, de manganate de potassium est de couleur verte ; une solution, notée B, de permanganate de potassium est de couleur rose violet. Couples redox : MnO42-/ Mn2+ et MnO4- /MnO42-. Analyse : Questions relatives aux mots " oxydation, réduction, oxydant, réducteur, dismutation". Remarques : le mot "amphotère" ou ampholyte" est réservé aux couples acide / base. L'ion manganèse Mn2+ est incolore. " la teinte verte disparaît, une coloration rose apparaît " signifie : MnO42- , un réducteur, s'oxyde en MnO4- ; la réaction est une oxydation. 4 fois { MnO42- = MnO4- + e- }. MnO42- libère 1 électron. Or une réduction accompagne toujours une oxydation. MnO42- , un oxydant, se réduit en Mn2+ ; la réaction est une réduction. MnO42- +8H+ + 4e- = Mn2+ + 4H2O. MnO42- gagne 4 électrons. Bilan : 5 MnO42- +8H+ = 4MnO4- + Mn2+ + 4H2O MnO42- joue un double rôle, oxydant et réducteur ; MnO42- se dismute : la réaction est une dismutation. Seules les affirmations contenant l'une des informations ci-dessus seraient exactes.
acide oxalique H2C2O4 et ion permanganate MnO4-.
Texte : on fait réagir V=20 mL de solution de permanganate de potassium de concentration C=0,10 mol/L avec V= 20 mL d'une solution d'acide oxalique de concentration Ca =0,25 mol/L. Le mélange initial est violet. Couples redox : MnO4-/ Mn2+ et CO2 /H2C2O4. 2 fois { MnO4- + 8H+ + 5e- = Mn2+ + 4 H2O } L'oxydant MnO4- se réduit. 5 fois { H2C2O4 = 2 CO2 + 2H+ + 2e-} Le réducteur H2C2O4 s'oxyde. 5H2C2O4 + 2MnO4- + 6H+ = 10 CO2 + 2Mn2++ 8H2O. Questions relatives aux mots " réactif en excès, en défaut, stoechiométrique". Quantité de matière (mol) = concentration (mol/L) * volume (L). Au départ : n(MnO4- ) =CV = 0,10*0,02 = 2 10-3 mol et n(H2C2O4 ) = CaV = 0,25*0,02 = 5 10-3 mol
Si H2C2O4 est en défaut : 0,005-5xmax =0 ; xmax =0,001 mol Donc réactifs en proprotions stoechiométriques. Questions relatives à l'évolution de la couleur. Seul l'ion permanganate est coloré ( violet). A la fin de la réaction, l'ion permanganate est entièrement consommé : la teinte violette s'atténue lentement jusqu'à disparaître. Questions relatives à la vitesse de la réaction. Concentrations des réactifs et température sont des facteurs cinétiques. Le temps de demi-réaction t½ : à t½ l'avancement est égal à la moitié de l'avancement final.
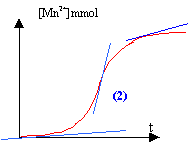
L'ion Mn2+ sert de catalyseur ( autocatalyse) et au début la quantité de catalyseur est nulle. La tangente est pratiquement horizontale : la vitesse est quasiment nulle. La quantité de matière d'ion Mn2+ augmente et en conséquence la vitesse de la réaction. La quantité de matière des réactifs diminue au cours du temps : ce second facteur va faire décroître la vitesse de la réaction au bout d'un temps assez long. Ce phénomène porte le nom d'autocatalyse : l'un des produits de la réaction sert de catalyseur.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||