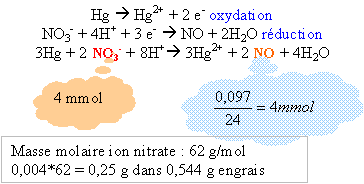|
Concours kiné Berck : 9 années de QCM oxydoréduction, pile, électrolyse En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||
|
Quel est le pourcentage massique en ion nitrate de cet engrais ?
0,25/0,544 *100 = 46%.
charge
élémentaire : e = 1,6
10-19 C ; nombre d'Avogadro N= 6,02
1023 mol-1. Zn : 65,4 g/mol ; Ag : 108
g/mol Parmi les
affirmations suivantes, quelles sont celle qui sont
exactes ? A l'anode le zinc est
réduit en ion
Zn2+.
Faux. oxydation du zinc à
l'anode : Zn(s) = Zn2+ +
2e-. La résistance
interne de la pile est environ 4
ohms.
Vrai. tension à vide aux
bornes de la pile E = 0,8-(-0,76) =
1,56V. tension aux bornes de la
pile en fonctionnement : U=E-rI= RI r = E/I -R= 1,56/0,042-33
=4
W. La capacité de
la pile est de 11,34
Ah.
Faux. Q= I t = 0,042*27
=1,13
Ah. La masse de zinc ayant
disparu au cours du fonctionnement de la pile est
de 1,4 g environ.
Vrai. Q= 1,134 *3600 = 4082
C Quantité de
matière d'électrons : n = 4082/96500
=0,0423 mol. Quantité de
matière de zinc : 0,0423/2 =0,0211
mol Masse de zinc m=n M =
0,0211*65,4 =1,38
g. La masse d'argent
s'étant formé au cours du
fonctionnement de la pile est de 4,6 g
environ.
Vrai. Ag+
+e- = Ag. n(Ag)= n(e-) =
0,0423 mol masse d'argent : m= n M =
0,0423*108 = 4,6
g.
Les ions thiosulfate S2O32- réagissent avec le diiode I2 en solution pour donner des ions iodure I- et des ions tétrathionate S4O62-. On verse 15 mL de solution de diiode de concentration C= 6 10-3 mol/L dans une solution contenant des ions thiosulfate. Déterminer la quantité maximale ( en micromole) d'ions thiosulfate pouvant réagir avec le diiode. 2S2O32- + I2 = 2 I- + S4O62-. à l'équivalence : n thiosulfate = 2nI2 =2*15 10-3*6 10-3 = 180 10-6 mol = 180 mmol.
2 MnO4- + 5 CH3-CH2OH + 6H+ --> 5 CH3-CHO + 2Mn2+ + 8H2O Parmi les affirmations suivantes, combien y-en-a-t-il d'exactes ? L'éthanol joue le rôle de réducteur. exact Les ions permanganate libèrent 5 électrons exact MnO4- + 8H+ + 5e-= Mn2+ + 4H2O. Il s'agit d'une réaction de réduction ménagée d'un alcool faux, oxydation ménagée d'un alcool. Le produit formé est une cétone faux, un alcool primaire conduit d'abord à un aldehyde. Un test à la DNPH en fin de réaction donne une couleur jaune, caractéristique du groupe carbonyle.exact 3 affirmations
exactes.
|
||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||
|
|