On saponifie totalement 28,5 g d'un corps gras en
utilisant 50 mL de soude de concentration 2 mol/L. Le corps
gras est un triglycéride dont les 3 chaînes
carbonées sont identiques. Pour doser la
quantité de soude en excès, il faut 4 mL de
solution d'acide chlorhydrique de concentration 1 mol/L.
Quelle est la masse molaire m du
corps gras ( g/mol) ?

La quantité de matière de
triglycéride est n=28,5/M ; celle d'hydroxyde de
sodium est n/3 = 0,096/3 =0,032 mol.
M= 28,5/0,032 = 890
g/mol.
Dans un ballon on introduit 69 g d'éthanol et 23 g
d'acide méthanoïque. On maintient une
ébullition pendant 1 heure. On prélève
le dixième du liquide et on le dose avec la soude de
concentration 0,5 mol/L. Il faut verser 20 mL de soude pour
que le bleu de bromothymol change de couleur.
Quel est le rendement en ester
formé (%) ?
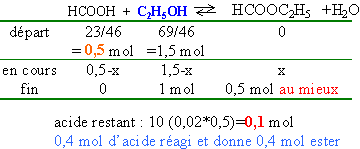
rendement 80%.
|
On verse 14,2 g d'acide propanoïque et
8,1 g de 3-méthylpentan-1-ol dans un ballon.
On ajoute 2 mL d'acide sulfurique concentré
et quelques grains de pierre ponce. On effectue un
chauffage à reflux pendant 50 min. On
détermine par un titrage approprié
qu'il s'est formé 4,8 g d'ester.
Parmi les propositions suivantes combien y
en a-t-il d'exactes ?
La pierre ponce permet de
réguler l'ébullition lors du
chauffage à reflux.
Vrai.
L'acide sulfurique permet
d'augmenter le rendement lors de la synthèse
de l'ester.
Faux.
L'acide sulfurique est un catalyseur : il
augmente à la fois la vitesse
d'estérification et celle d'hydrolyse de
l'ester. Le catalyseur n'augmente pas le rendement,
on atteint plus rapidement l'équilibre.
L'acide propanoïque a
été introduit en excès par
rapport à l'alcool.
Vrai.
masse molaire : acide
propanoïque CH3-CH2-COOH
: 74 g/mol
alcool :
CH3-CH2-CH(CH3)-CH2-CH2OH
( C6H14O) : 102 g/mol
ester
CH3-CH2-COO-CH2-CH2-CH(CH3)-CH2-CH3
: 158 g/mol
Qté de matière :
acide :14,2/74 = 0,192 mol
alcool : 8,1 / 102 =0,08 mol ( en défaut)
donc x max = 0,08 mol
La formule
semi-développée de l'ester
s'écrit :
CH3-CH2-CH2-COO
-CH2-CH2-CH(CH3)-CH2-CH3.
Faux.
CH3-CH2-COO
-CH2-CH2-CH(CH3)-CH2-CH3.
|
|
L'éthanoate de butyle est obtenu par
chauffage à reflux pendant 1 heure d'un
mélange de 60 mL d'acide
éthanoïque et de 40 mL de butan-1-ol en
présence de 2mL d'acide sulfurique
concentré et de quelques grians de pierre
ponce. Après séparation et
purification on obtient 27 g d'éthanoate de
butyle.
Données : masse volumique butan-1-ol
: 800 kg/m3 ; masse volumique acide
acétique 1050 kg/m3
masse molaire (g/mol) : acide acétique
60 ; butan-1-ol 74 ; éthanoate de buthyle
116.
Combien d'affirmations sont exactes ?
a- L'acide sulfurique joue le rôle de
catalyseur.
b- On chauffe le mélange pour
améliorer le rendement
c- La pierre ponce permet d'absorber l'eau au fur
et à mesure de sa formation.
d- L'acide éthanoïque est le
réactif limitant.
e- le rendement est d'environ 54%
b:
fausse " pour
atteindre plus rapidement l'équilibre"
c:
fausse "
régularise le chauffage"
d: fausse
: alcool : 40*0,8
= 32 g ; 32/ 74 = 0,432 mol
acide éthanoïque : 60*1,05 = 63g ;
63/60 = 1,05 mol ( en excès)
Qté de matière théorique
d'ester : 0,432 mol ou 0,432*116 = 50,16 g
rendement 100*27/50,16 = 54%
L'aspirine est préparée par action
d'anhydride éthanoïque sur l'acide
salycilique
CH3-CO-O-CO-CH3 +
HO-C6H4-COOH =
CH3-COO-C6H4-COOH
+ CH3-COOH
On introduit dans un erlenmeyer 7 g d'acide
salycilique (M=138 g/mol) et 12 mL d'anhydride
éthanoïque ( M=102 g/mol ;
densité 1,08 ). Le rendement de la
réaction est 63%
Calculer la masse
d'aspirine obtenue ( M= 180 g/mol) (
5,75 ; 6,42 ; 6,83 ; 7,84 ; 9,13 ; aucune bonne
réponse)
7/ 138 = 0,05 mol
acide salycilique . 12*1,08/102 = 0,127 mol
anhydride
l'acide salycilique est le réactif limitant
; on peut obtenir au plus 0,05 mol d'aspirine
0,05*180*0,63 =
5,75 g.
|
On réalise la déshydratation d'un volume de 15
L de butan-2-ol. On obtient une masse de 6,6 kg de
but-2-ène. Densité de l'alcool d= 0,81.
Calculer le rendement de cette
transformation.
alcool :
C4H10O : Malcool =
4*12+10+16=74 g/mol ; alcène
C4H8 : Malcène = 56
g/mol
masse d'alcool : 15*0,81 =12,15 kg = 1,21 104
g.
Qté de matière alcool (mol) = masse (g) /
masse molaire butan-2-ol) (g/mol) =1,21 104 /74
=164,2 mol
C4H10O
-->
C4H8 + H2O
On obtient 164,2 mol de but-2-ène
soit une masse m =164,2*56 =9,2 kg
rendement : 6,6/9,2*100 =
72%.
On fait le vide dans un flacon que l'on
remplit avec un alcane gazeux A. On détermine
à l'aide d'une balance la masse de gaz introduit pour
remplir le flacon : mA= 6,473 g. On fait de
nouveau le vide dans le flacon et on le remplit, dans les
mêmes conditions de température et de pression,
d'éthane gazeux E. La masse d'éthane vaut
mE= 3,348 g. (C: 12 ; H : 1 g/mol)
Calculer la masse molaire ( g/mol)
de l'alcane A. ( 44 ; 54 ; 58 ; 72 ; 86 ; aucune
réponse)
Quantité de matière (mol) = masse (g) / masse
molaire (g/mol)
Pour E( C2H6) : M= 2*12+6 = 30 g/mol ;
nE = 3,348 / 30 mol
Pour A : nA= 6,473 / M
Un même volume de gaz ( dans les mêmes
conditions de température et de pression) renferme le
même nombre de mole soit nE =
nA.
M= 30*6,473/3,348 = 58
g/mol.
Combien y a-t-il d'affirmations exactes ?
- La masse molaire d'un alcane non cyclique possédant
n atomes de carbone se calcule par M= 12 n+ 2
(Faux)
c'est CnH2n+2 d'où : M= 14
n+2
- La formule brute des cyclanes ( alcanes cycliques)
s'écrit :
CnH2n(Vrai)
- Un alcane est un hydrocarbure à chaîne
ouverte insaturée
(Faux)
c'est " chaîne ouverte saturée"
- La température d'ébullition des alcanes
linéaires diminue régulièrement lorsque
le nombre d'atomes de carbone
augmente.(Faux)
- le nom de
(CH3)3-CH2-CH3
est
2-diméthylbutane(Faux)
c'est "2,2-diméthylbutane"

