Etude d'une pile
nickel-cadmium.
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
.
.
|
|
|
|
La pile
nickel-cadmium au laboratoire.
Elle est constituée de deux demi-piles reliées par un pont salin et
mettant en jeu les couples oxydant-réducteur Ni2+(aq) /
Ni(s) et Cd2+(aq) / Cd(s). Chaque demi-pile contient 20 mL
de solution aqueuse de même concentration C0 = 0,10 mol.L-1.
- l’une de sulfate de nickel (Ni2+(aq) + SO42–(aq))
à pH=0
- l’autre de sulfate de cadmium (Cd2+(aq) + SO42–(aq))
à pH=0
1.1. Elaborer le
mode opératoire permettant de préparer V=100,0 mL d’une solution de
sulfate de nickel de concentration C0 à partir de sulfate de
nickel hexahydraté, solide. Sulfate de nickel (II) hexahydraté M =
262,86 g.mol-1.
Quantité de matière de soluté : n = VC0 = 0,100*0,10 =1,0 10-2
mol.
Masse de solide à peser ( capsule sur une balance ): nM =1,0 10-2
*262,86 = 2,63 g.
Verser le solide dans une fiole jaugée de 100,0 mL ; remplir la fiole
au 3/4 d'eau distillée ; agiter pour dissoudre le solide.
Compléter la fiole jusqu'au trait de jauge avec de l'eau distillée (
finir avec un compte gouttes).
Agiter pour rendre homogène.
1.2. Sachant que l’électrode
positive est constituée par l’électrode de nickel, représenter la pile
Cd/ Cd2+ // Ni2+/Ni, et faire apparaître le
déplacement des porteurs de charge.
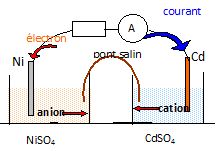
1.3.
Quel type de réaction se produit à l’anode ?
A l'anode négative en cadmium se produit l'oxydation du métal.
1.4.
Quel type de réaction se produit à la cathode ?
A la cathode positive en nickel se produit une réduction des ions Ni2+aq.
1.5.
Ecrire la réaction qui se produit à chaque électrode puis la réaction
globale.
Anode : Cd(s) --> Cd2+aq + 2e-.
Cathode : Ni2+aq + 2e-.---> Ni(s).
Bilan : Cd +Ni2+aq --> Cd2+aq+Ni(s).
1.6. Quel est le rôle du pont salin ?
Il assure la continuité électrique, sans
mélange des solutions.
Il permet l'électroneutralité des solutions.
1.7. On
laisse débiter la pile. Comment évolue la concentration en ions Nickel ?
Les ions nickel sont réduits : la concentration en ion nickel diminue.
Pour vérifier cette évolution, on utilise un spectrophotomètre. On
obtient alors les 2 documents ci-dessous donnant respectivement
l’évolution de l’absorbance d’une solution de sulfate de nickel, en
fonction de la longueur d’onde et l’évolution de l’absorbance à 400 nm
en fonction de la concentration en ion nickel.
|
|
|
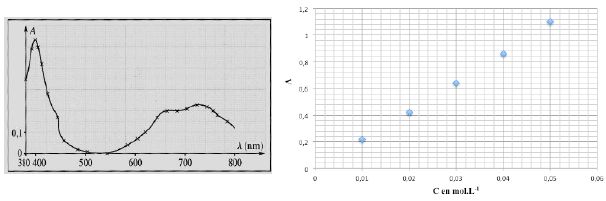
1.8. Rappeler la loi de Beer-Lambert.
Absorbance et concentration de l'espèce colorée sont proportionnelles.
A = e l c ( l épaisseur de la cuve en
cm, c en mol/L et e
en L mol-1 cm-1).
1.9. Donnez l’équation de la courbe
représentant la fonction A = f(C).
Coefficient directeur de la droite : 0,64 / 0,03 =21,33 ~21 L mol-1.
A = 21 C.
A une date t1, on mesure A =
0,95. Quelle est la concentration en ions nickel de l’électrolyte à
cette date ? Ce résultat
est-il cohérent avec la réponse donnée à la question 1.7 ?
C = 0,95 / 21,33 ~0,045 mol/L, valeur inférieure à la concentration
initiale c0. Donc, accord.
|
|
|
|
L'accumulateur
nickel-cadmium.
L’électrolyte de la batterie Nickel-Cadmium est en fait une solution
très alcaline. De ce fait la force électromotrice de la pile est alors
de 1,35V.
(-) acier | Cd(s), Cd(OH)2(s) | Li(OH)aq | NiO(OH)(s),
Ni(OH)2(s) | acier (+)
La réaction de décharge de l’accumulateur est alors : Cd(s) + 2
NiO(OH)(s) + 2 H2O(l) = Cd(OH)2(s) + 2 Ni(OH)2(s)
2.1. Quelle est la
différence entre une pile et un accumulateur ?
Une
pile ne se recharge pas ( processus chimiques irréversibles) ; un
accumulateur se recharge ( processus chimiques réversibles ).
2.2. Compléter la
troisième ligne du tableau descriptif de l’évolution du système
(expressions littérales). Le cadmium est le réactif limitant.
|
Avancement
(mol)
|
Cd(s)
|
+2NiO(OH)(s)
|
+2H2O(l)
|
=Cd(OH)2
(s)
|
+Ni(OH)2(s)
|
n(e-)
|
Initial
|
x=0 |
n0 |
excès
|
excès
|
n2
|
n3
|
0
|
| Final |
xmax
= n0
|
n0-xmax=0 |
excès
|
excès
|
n2+xmax
|
n3+xmax
|
2
xmax
|
2.3. Déterminer la quantité maximale d’électricité que peut
débiter cet accumulateur pour une masse initiale de cadmium égale à m =
2,0 g.
M(Cd) = 112,4 g/mol.
n0 = 2,0 /112,4 ~1,78 10-2 mol.
n(e-) = 2n0 = 3,56 10-2 mol.
Charge d'une mole d'électrons : 96500 C mol-1.
Q = 96500*3,56 10-2 =3,43 103~3,4
103 C ou 3,43 103 / 3600 ~0,95 Ah.
Un fabriquant propose des piles
rechargeables Ni/Cd de capacité 800 mAh pouvant être rechargées en 15
minutes.
2.4. Quelle est la
valeur de la capacité de cette pile en unité SI ?
Q= 0,800 Ah = 0,800*3600 C = 2,88 103 C.
2.5. L’accumulateur
étant totalement déchargé, on veut obtenir à nouveau, une capacité de
800 mAh. Quelle est l’intensité nécessaire en courant constant pour
réaliser la charge rapide en 15 minutes ?
I = Q / t = 2,88 103
/(15*60)=3,2 A.
|
|
|
|