Cinétique chimique : ordre de réaction
![]() ordres
de réaction 0, 1 ou 2 : temps de
demi-réaction
ordres
de réaction 0, 1 ou 2 : temps de
demi-réaction
| .
. |
| .
. |
Soit une réaction dont le bilan est : A-->B ; la vitesse de réaction s'écrit : v=k[A]a.
a est l'ordre de la réaction, 0, 1 ou 2 ; k est la constante de vitesse. On note [A]0 la concentration initiale du réactif A.
Pour chaque valeur de a :
- Comment déterminer graphiquement la constante de vitesse k. Quelle est son unité ?
- Quelle est la représentation de [R] en fonction du temps ?
- Déterminer le temps de demi-réaction .
corrigé
la vitesse de réaction s'écrit : v= -d[A] /dt
la concentration [A] est solution de l'équation différentielle : -d[A] /dt =k[A]a.
réaction d'ordre 0 : -d[A] /dt =k0.
d'où [A]= -k0t + [A]0 droite de pente opposée à la constante de vitesse k0.
k0 s'exprime en mol L-1 s-1.
temps de demi-réaction t½ : durée au bout de laquelle la moitié du réactif limitant a été consommée.
à t½ [A]=½[A]0 d'où ½[A]0 = -k0t ½ + [A]0 soit t ½ =[A]0 /(2k0).
réaction d'ordre 1 : -d[A] /dt = k1[A] ; k1 s'exprime en s-1.
d'où d[A] /[A]= -k1dt soit : ln[A] = -k1t +ln[A0]
Tracer la courbe d'équation ln [A]= f(t) , droite de pente -k1.
temps de demi-réaction t½ : ln(½[A0] )= -k1t ½ +ln[A0] ; t ½ =ln2 /k1.
réaction d'ordre 2 : -d[A] /dt = k2[A]2 ; k1 s'exprime en L mol-1 s-1.
d'où d[A] /[A]2= -k2dt soit : 1/[A] = k2t +1/[A0]
Tracer la courbe d'équation 1/[A] = f(t) , droite de pente k2.
temps de demi-réaction t½ : 1/(½[A0] )= k2t ½ +1/[A0] ; t ½ =1 /(k2[A0] ).
Considérons la réaction A-->B+C. La vitesse de réaction peut se mettre sous la forme v= k[A]a où a est un réel. L'évolution de la concentration du composé A et de la vitesse -d[A]/dt sont donnés dans le tableau ci-desous :
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(molL-1min-1) |
|
|
|
|
|
|
|
- Déterminer les grandeurs k et a.
corrigé
la concentration [A] est solution de l'équation différentielle : -d[A] /dt =k[A]a.
soit ln (-d[A] /dt)=ln k + a ln[A], droite de coefficient directeur a et d'ordonnée à l'origine ln k.
si a=0, réaction d'ordre zéro : -d[A] /dt doit être une constante, ce qui est contraire aux données du tableau.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(molL-1min-1) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
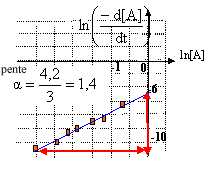
l'ordonnée à l'origine est égale à -6,4 : ln k=-6,4 d'où k = 1,7 10-3 (mol L-1)1,4 -1 min-1.
Oxydation des ions iodures I- par les ions
peroxodisulfates S2O82- en
solution aqueuse.
2I-+S2O82-
=I2 + 2SO42-.
La réaction admet l'ordre partiel p par rapport aux
ions iodures et un ordre partiel n par rapport à
S2O82- . A la date t=0 on
mélange 25 mL d'une solution d'iodure de potassium
à 0,25 mol/L et 15 mL d'une solution de
peroxodisulfate d'ammonium à 6,25 10-3
mol/L.
- Ces conditions initiales permettent de déterminer l'ordre n de la réaction.Justifier. Donner l'expression de la constante de vitesse apparente.
- On mesure l'absorbance du mélange au cours du
temps. Seul le diiode formé est coloré donc
responsable de l'absorbance. On rappelle la loi de Beer
Lambert donnant l'absorbance A d'une solution de
concentration c placée dans une cuve de longueur L
: A=eALc avec
eA le coefficient
d'extinction molaire de la substance absorbante à
la longueur d'onde l= 454 nm.
A = 1250 L mol-1
cm-1.
- Expliquer comment la mesure de l'absorbance permet de déterminer la concentration des ions peroxodisulfate au cours du temps.
- On obtient les résultats suivants :
Montrer que ces résultats sont en accord avec une cinétique d'ordre n=1.t (min) 0 4 8 12 16 A 0 0,35 0,67 0,94 1,18
Calculer la constante de vitesse apparente.
corrigé
à l'instant initial, on a introduit : 25 10-3*0,25 = 6,25 10-3 mol d'ion I- et 15 10-3*6,25 10-3 = 9,37 10-5 mol d'ion peroxodisulfate. Les ions iodures sont en grand excès et la concentration des ions iodures peut être considérée comme constante.
La vitesse de la réaction s'écrit : v = k [I- ]p[S2O82-]n avec k la constante de vitesse.
v = k' [S2O82-]n avec k' = k [I- ]p, constante de vitesse apparente.
La réaction admet l'ordre partiel n par rapport aux ions peroxodisulfate.
D'après la loi de Beer, la concentration en diiode [I2] est proportionnelle à l'absorbance A : [I2] = A/(eAL) = A/1250.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
volume du mélange 0,04 L d'où : [S2O82- ]=9,37 10-5 /0,04 - [I2]= 2,34 10-3 -A/1250.
si la cinétique est d'ordre 1, on trace ln[S2O82- ] en fonction du temps :on doit alors obtenir une droite dont la pente donne l'opposé de la constante de vitesse apparente k'.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
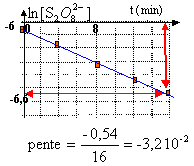
k' = 3,2 10-2 min-1.
retour - menu