|
|
|||||||||||||||||||||||||||||||||
|
niveaux d'énergie de l'atome d'hydrogène |
corrigé |
||||||||||||||||||||||||||||||||
|
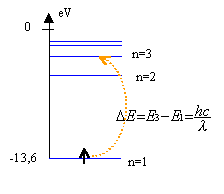
L'énergie de l'atome d'hydrogène est donnée par E=-13,6 / n² en eV.
Le photon est absorbé si son énergie est égale à E3-E1= -1,51-(-13,6)=12,09 eV à exprimer en joule (12,09*1,6 10-19 =1,93 10-18 J) pour le calcul de la longueur d'onde . l =6,62 10-34*3 108 / 1,93 10-18 =1,03 10-7 m. énergie du photon de longueur d'onde 8,5 10-8m : E=6,62 10-34*3 108 / 8,5 10-8= 2,336 10-18 J =14,6 eV cette valeur est supérieure à 13,6 eV, l'électron situé au niveau fondamental est arraché.
|
|||||||||||||||||||||||||||||||||
|
ions hydrogénoïdes |
corrigé |
||||||||||||||||||||||||||||||||
|
structure électronique de l'hélium : 1s2 2s1. L'énergie d'ionisation est l'énergie de la réaction suivante : H(g) --> H+(g) + e-. Ei=EH+-E1=13,6 eV. Un ion hydrogénïde posséde un électron et Z protons : il a la même structure électronique que l'atome d'hydrogène. Li2+ est un ion hydrogénoïde. Energie de l'électron dans l'état fondamental : E Li2+ = -13,6 (Z / n)² avec n=1 énergie d'ionisation = E Li2+ = 13,6 (Z / n)² ELi2+= EH+ *Z²= 13,6*3²= 122,4 eV=1,96 10-17 J. 1,96 10-17 *6,02 1023=11 800 kJ mol-1. La plus petite longueur d'onde correspond au photon le plus énergétique capable d'arracher le dernier électron de l'atome. L'énergie de ce photon est : E=6,62 10-34*3 108 / 1,87 10-9=1,06 10-16 J= 662,5 eV 662,5 =13,6 Z² Z=6,98 voisin de 7 .(élément azote)
|
|||||||||||||||||||||||||||||||||
|