|
.
. |
d'après olympiades 99 Nantes En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
|
|
||
|
concentration titre massique iodomètrie |
La vigne nécessite des traitements, particulièrement celui du mildiou, par le sulfate de cuivre II. Le sulfate de cuivre II est un composé du cuivre très utilisé, il cristallise avec n molécules d'eau. Sachant qu'une solution S à 10 g./L de sulfate de cuivre hydraté (CuS04 n H2O ) contient 0,04 mol d'ions Cu2+, Cu : 63,6 g/mol ; S : 32 g/mol ; O : 16 g/mol
corrigé |
|
|
|
la solution à 100g/L est 10 fois plus concentrée que la solution précédente : elle contient 0,4 mol d'ion Cu2+. masse molaire sulfate de cuivre : 159,5 g/ mol masse CuSO4 : 159,5*0,4 = 63,8 g donc 100-63,8 = 36,2 g d'eau ou 2 mol. 2,5 fois{0,4 mol CuSO4 et 2 mol d'eau} CuSO4,
5H2O.
lors du dosage du diiode, la coloration brune disparaît à l'équivalence. En présence d'empois d'amidon le diiode donne une coloration violette presque noire. A l'équivalence cette coloration violette noire disparaît : I2+ 2S2O32- --> 2I- +S4O62-. Quantité de matière (mmol) : thiosulfate à l'équivalence : 0,1*12 =1,2 mmol I2 formé : 1,2 / 2 =0,6 mmol ion Cu2+ : 1,2 mmol dans 25 mL [Cu2+]=1,2/25 = 0,048 mol/L 0,048*63,5 =3,048 g Cu2+/L 0,048*159,5 = 7,65 g CuSO4 /L
|
|
|
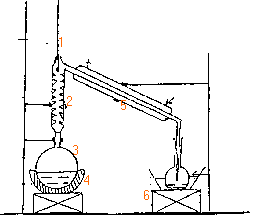
dosage de l'éthanol degré d'un vin |
Les vendanges ont été bonnes. Le vin est
tiré. Le vin provient de la fermentation du jus de
raisin grâce à des levures présentes
dans la pellicule du fruit. Cette fermentation consiste
essentiellement en l'oxydation du glucose (
C6H12O6) en éthanol
et en dioxyde de carbone. On retrouve aussi des substances
présentes initialement dans le raisin. Dosage de l'éthanol Protocole opératoire: On place dans un ballon rodé 20mL de vin, 200mL d'eau distillée, on distille ce mélange 30 min et on obtient 50mL de distillat "on verse ce dernier dans une fiole jaugée de 250 mL et on complète avec de l'eau distillée, cette solution est notée S1.
Analyses :
corrigé |
|
|
|
(5) réfrigérant à eau; (6) élévateur à croisillon oxydation du glucose : C6H12O6 --> 2CO2+2C2H5OH la distillation permet de séparer l'éthanol des autres constituants du vin. 2 fois{Cr2O72- +14H+ + 6e- --> 2Cr3+ +7H2O }réduction 3 fois{ C2H6O +H2O--> C2H4O2 +4e-+4H+ } oxydation 2Cr2O72- +16H+ +3C2H6O --> 3C2H4O2+4Cr3+ +11H2O (1) l'acide sulfurique H2SO4 est l'un des réactifs. masse de dichromate dissoute dans 1 L de solution masse molaire 2*39+2*52+7*16=292 g/mol 292*0,115 = 33,6 g. oxydant en défaut : l'éthanol conduit à l'aldehyde, l'éthanal au bout de 20min, (oxydant en excès) tout l'alcool est oxydé en acide éthanoïque. le sel de Mohr solide contient les ion Fe2+, NH4+, SO42-. 6Fe2+--> 6Fe3++6e- oxydation Cr2O72- +14H+ + 6e- --> 2Cr3+ +7H2O réduction Cr2O72- +14H+ +6Fe2+--> 6Fe3++2Cr3+ +7H2O (2). quantités de matière : ion fer II : C1V1 mmol ion dichromate en excès : C1V1 / 6 ion dichromate total : C2V2 ion dichromate ayant réagi avec l'alcool : C2V2 -C1V1 / 6 alcool : 1,5(C2V2 -C1V1 / 6). 1,5 (0,115*20-0,7*10,3/6)= 1,65 mmol d'alcool dans 10 mL de S1. 1,65*25 =41,25 mmol alcool dans 250 mL S1ou dans 20 mL vin [alcool]=41,25/20= 2,06 mol /L masse d'alcool : 46*2,06 = 94,8g/L masse volumique éthanol : 0,8 g/mL volume alcool: 94,8 / 0,8 =118,4 mL alcool dans 1L de vin ou 11,8°.
|
|
|
|
|
|