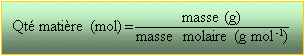|
.
. |
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
|
|
||
|
fermentation |
L'éthanol contenu dans le vin résulte de la fermentation des sucres présents dans le moût de raisin. On peut considérer, pour simplifier, que seuls le glucose et le fructose subissent cette fermentation.
Masse volumique de l'éthanol : 790 kgm-3. C=12 ; H=1 ; O=16 g mol-1. volume molaire : 22,4 L mol-1.
corrigé |
|
|
|
étape 1: qté de matière en mole masse de sucres dans le raisin :0,189*1000= 189 kg masse molaire glucose C6H12O6 :180 g mol -1.
diviser 189 000 gramme par 180 = 1050 mol de glucose étape 2 : écrire l'équation bilan de la réaction 1 C6H12O6 donne 2 C2H5OH + 2 CO2 utiliser les coefficient de l'équation bilan pour trouver la qté de matière d'alcool éthylique en moles. 2*1050=2100 mol étape 3 : masse de l'alcool éthylique multiplier le résultat précédent par la masse molaire de l'alcool éthylique C2H5OH soit 46 g mol-1 d'où : 96 600g d'alcool utiliser la masse volumique de l'éthanol : 790 kg m-3 = 0,79 g / mL diviser la masse d'alcool par 0,79 d'où un volume en mL d'alcool 96 600/0,79 =1,223 105 mL ou 122,3 L d'éthanol dioxyde de carbone à partir de 1050 mol de glucose, utiliser les coefficients de l'équation bilan pour trouver la quantité de matière de CO2 en mol 2*1050 =2100 mol multiplier ce résultat en mol par le volume molaire d'un gaz (22,4 L / mol en général ou la valeur que l'on vous donne); d'où le volume de CO2 en litres. 2100*22,4 =47000 L ou 47 m3 Le volume d'air doit être 10 fois plus grand.(470 m3)
retour - menu |
|