| |
estérification et stéréochimie sport de haut niveau 10 / 99 En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
||||||
|
|
ester isomères carbone asymétrique rendement
|
masses atomiques molaires g /mol : H=1 ; C=12 ; O=16 L'éthanoate d'isoamyle a une forte odeur de babane mûre. Pour le synthétiser on utilise una acide A et un alcool B nommé isoamylique de formule brute C5H11OH.
|
|||||
| |
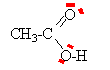
molécules 1, 4, 8 : le squelette carboné est différent donc isomères de chaine molécules 4, 5, 6,7 : même squelette carboné, la position de la fonction alcool différe donc isomères de position. Les carbone asymétriques sont tétragonaux et sont liés à 4 groupes différents. Ils ont été écrits en rouge dans les formules ci dessus. Les fonctions alcools entourées de bleu sont des alcools secondaires celles entourées de jaune sont des alcools primaires celle entouré de vert est un alcool tertiaire. 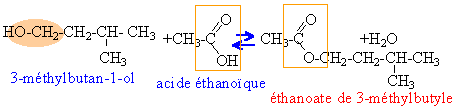
réaction lente, athermique et limitée par l'hydrolyse de l'ester. la température est un facteur cinétique qui augmente la vitesse de la réaction. Un catalyseur (ion hydronium par exemple) est un facteur cinétique : il permet d'atteindre plus rapidement l'équilibre sans en modifier la composition. Quantité de matière acide : 15 /60 =0,25 mol alcool : 22 /88 =0,25 mol mélange équimolaire et alcool primaire : la quantité théorique d'ester formé est : 66,7 %s soit 0,25*0,667 = 0,1667 mol masse molaire de l'ester : 130g /mol donc en masse 130*0,1667 = 21,67 g. acide restant : 0,25 * 0,333 = 0,083 mol ou 0,083*60 = 5 g alcool restant : 0,25 * 0,333 = 0,083 mol ou 0,083*88 = 7,3 g
|
||||||
|
|
|