| |
solubilité du phénol ( bac juin 2000) En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|||||||||||||||||||||||
|
|
dosage phénol par la soude |
Pour une température de 25 °C et sous une pression de 1 bar, le phénol est un solide faiblement soluble dans l'eau. Il est irritant pour la peau. Sa formule est C6H5OH. Sa masse molaire moléculaire est : M = 94 g . mol -1 .En solution aqueuse, le phénol est un monoacide faible dont la base conjuguée est l'ion phénolate de formule C6H5O - .On se propose de déterminer expérimentalement, à 25 °C, la solubilité du phénol dans l'eau c'est-à-dire la masse maximale de phénol dissoute dans un litre de solution aqueuse. Dans tout l'exercice les solutions étudiées sont à 25 °C.
Réaction du dosage.
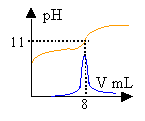 Exploitation du dosage.
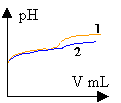
|
||||||||||||||||||||||
| |
La solubilité du phénol à 25 ° est inférieure à 10 g/L. prélever environ 100 mL d'eau à l'aide d'une éprouvette graduée de 100 mL . pipette et burette sont utilisés pour prélever un volume précis; avec le bécher cela serait trop imprécis. La solution de soude est assez concentrée: prendre des gants (éviter le contact avec la peau) et mettre des lunettes de protection. C6H5OH + HO- donne C6H5O- + H2O. H2O / HO- : pKa1 = 14 C6H5OH / C6H5O - pKa1 = 9,9 réaction entre la base la plus forte et l'acide le plus fort et la différence des pka est 4,1. constante de la réaction Kr=104,1 =12600, réaction totale. Donc elle peut servir de support à un dosage. A l'équivalence acido basique les quantités de réactifs sont dans les proportions stoéchiomètriques. CaVa = Cb Vb A l'équivalence la courbe dpH/dV passe par un maximum. Ve=8 mL Ca=1*8 /10=0,8 mol L-1. soit 0,8*94=75,2 g /L. La zone de virage de l'indicateur coloré contient bien le pH à l'équivalence mais la variation de pH au voisinage de l'équivalence n'est pas très importante. En utilisant un indicateur coloré, la détermination de Ve est imprécise dans ce cas. Les concentrations des réactifs sont divisées par le même nombre. A l'équivalence on a CaVa=CbVb donc le volume de soude Vb reste inchangé. Avec ces solutions diluées il n'y a pas de saut de pH à l'équivalence. Alors qu'avec la solution concentrée on observait un saut relativement important.
|
|||||||||||||||||||||||
|
|
|
|||||||||||||||||||||||