| |
acidité d'un vin (bac sept 98) En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
||||||
| |
|
||||||
|
|
dosage acide faible base forte |
Le texte ci-dessous est un extrait d'un traité d'oenologie : L 'acidité renforce et soutient les arômes en apportant au vin du corps et de la fraîcheur tout en aidant à son vieillissement. L 'acide tartrique donne une impression de mordant ;c 'est le plus fort des acides organiques présents dans le vin. Excès d 'acidité : vin trop nerveux ,souvent maigre. Carence d 'acidité :vin mou. D 'après la réglementation européenne, l 'acidité se mesure en équivalent d 'acide tartrique .L 'acidité totale est la somme des acidités dosables lorsqu 'on amène le pH du vin à 7,0 par addition de soude. Un vin de table équilibré ne doit pas avoir une acidité totale inférieure à 4,5 g d 'acide tartrique par litre ;elle est rarement supérieure à 12,2 g par litre ". Parmi les acides faibles que peut contenir le vin, on trouve aussi : acide sulfureux : ;SO2,H2O / HSO3- pKa=1,9 ; HSO3- /SO32- pka=7,2 acide carbonique :CO2,H2O / HCO3- pKa=6,4 ; HCO3- / CO32- pKa =10,3 I - Étude préliminaire 1.Donner en fonction du pH, le domaine de prédominance des espèces relatives à l'acide carbonique puis à l'acide sulfureux. 2.Pour le vin étudié, on mesure un pH de 3,5. En déduire, pour les couples précédents, les espèces chimiques prédominantes dans ce vin. 3.La norme législative s'appliquant à la mesure de l'acidité totale d'un vin ne tient pas compte de l'acide carbonique éventuellement présent. Quelle opération préliminaire doit-on effectuer (méthode au choix) pour déterminer l'acidité d'un vin selon la norme ? II - Dosage On dose 20,0 mL de vin ainsi traité à l'aide d'une solution d'hydroxyde de sodium (soude) fraîchement préparée, de concentration molaire 0,1 mol /L. Un dispositif approprié permet : - d'enregistrer les valeurs du pH pour chaque volume v de soude versé, - de tracer la courbe représentative , - de calculer la dérivée du pH par rapport à v et de tracer sur le même graphique la courbe correspondante. 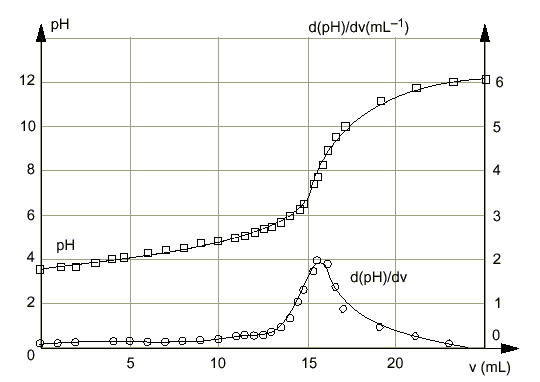
1.À pH=7 le point d'équivalence est-il atteint ? Justifier la réponse indépendamment des résultats expérimentaux. 2.À l'aide des résultats fournis ci-avant, déterminer le volume de soude nécessaire pour amener le pH du vin à 7,0. Quelle est la quantité (en moles) d'ions HO- correspondante ? III - Détermination de l 'activité totale en équivalent d 'acide tartrique selon la réglementation européenne 1.L'acide tartrique est un diacide noté H2A, de masse molaire 150g/mol. Écrire l'équation bilan de la réaction, supposée totale, entre l'acide tartrique et les ions hydroxyde , sachant que l'on obtient des ions tartrate .A2- 2.En déduire la quantité d'acide tartrique (en moles) qui réagirait avec la quantité d'ions déterminée en II - 2. 3.Si les 20,0 mL de vin ne contenaient que de l'acide tartrique, quelle en serait sa concentration molaire ? En déduire quelle en serait sa concentration massique. 4.Compte tenu de la réglementation européenne donnée dans le texte, exprimer un avis sur le vin étudié. IV - Vieillissement du vin Les réactions d'estérification se poursuivent lentement au fur et à mesure du vieillissement du vin. Que peut-on en conclure sur son évolution en acidité ?
|
|||||
| |
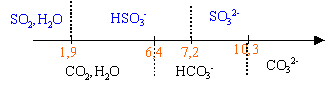
A pH =3,5 les espèces HSO3- et CO2,H2O prédominent. Un chauffage à reflux durant 15 minutes permet d'éliminer le gaz carbonique dissout. Lors du dosage d’un acide faible (ici l’acide sulfureux) par une base forte (ici la soude)le pH à l’équivalence est supérieur à 7. Donc pour pH=7 on n ’a pas encore atteint l ’équivalence. Le graphique permet de déterminer le volume de soude : à pH=7 , Vb =15 mL Quantité d'ion hydroxyde ajouté à pH=7 : 0,015*0,1 =1,5 10-3 mol. H2A+ 2HO- donne 2H2O + A2-. 1 5 / 2 =0,75 mmol d'acide tartrique réagissent avec 1,5 mmol d'ion hydroxyde. 0,75 mmol d'acide tartrique dans 20 mL de vin 0,75 / 20 =0,0375 mol / L d'acide tartrique 0,0375*150 = 5,62 g / L cette valeur est comprise entre 4,5 g/L et 12,2 g/L Ce vin de table est équilibré. L ’ester se forme au détriment de l'acide en vieillissant :l ’acidité du vin diminue peu à peu et au cours des années le vin deviendra « mou ».
|
||||||
|
|
|