| |
acidité totale d'un vin ( Nantes bac juin 97) En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
||||||
| |
|
||||||
|
|
chromatographie dosage
|
Parmi les nombreuses substances présentes dans une bouteille de vin fin, peuvent se trouver plusieurs acides organiques, parmi lesquels les acides éthanoïque, malique, tartrique et lactique. Au cours de l'élaboration du vin se succèdent deux modes de fermentation : - fermentation alcoolique transformant les sucres en éthanol avec un dégagement de dioxyde de carbone ; - fermentation malolactique transformant l'acide malique en acide lactique avec dégagement de dioxyde de carbone. L'acidité d'un vin diminue avec la fermentation malolactique et également par précipitation de l'acide tartrique à l'état de tartrates. Un vin est considéré comme biologiquement stable s'il ne contient plus de sucres fermentescibles et d'acide malique. Pour les vins rouges, les deux fermentations doivent être poussées jusqu'à leur terme. Si un vin est mis en bouteille alors que la fermentation malolactique n'est pas achevée, on ressent à la dégustation un certain pétillement et quelques bulles peuvent apparaître dans le verre, peu après l'ouverture de la bouteille. Avant de procéder à la mise en bouteille d'un vin, il est nécessaire de connaître le stade de la fermentation malolactique. Deux procédés utilisés pour suivre cette évolution sont la chromatographie et le dosage de l'acidité totale du vin. On donne les formules des acides concernés : acide éthanoïque H3C-CO2H acide tartrique H02C-CHOH-CHOH-CO2H acide malique HO2C-CH2-CHOH-CO2H acide lactique HO2C-CHOH-CH3 La fermentation malolactique Répondre aux questions suivantes en s'aidant du texte :
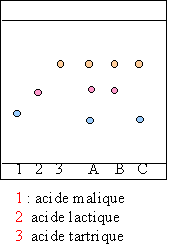
Suivi par chromatographie de la fermentation malolactique. On utilise : - le matériel classique pour chromatographie sur papier (cuve à chromatographie, papier à chromatographie, micropipette, sèche-cheveux ou étuve...) ; - comme " solvant " (éluant), un mélange de propan- 1 -ol, d'eucalyptol et d'acide méthanoïque ; - comme révélateur un mélange d'éthanol, de bleu de bromophénol et de soude, placé dans un pulvérisateur ; - différents échantillons d'acides et de vins.
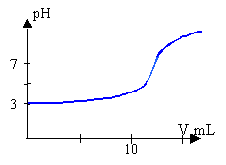
Quel est l'état de fermentation malolactique de chaque échantillon de vin ? Justifier votre réponse. Etude de l'acidité totale du vin. La législation en vigueur impose de ne pas tenir compte du dioxyde de carbone dissous dans le calcul de l'acidité totale d'un vin. Il est donc nécessaire de " décarboniquer " le vin au préalable (c'est-à-dire éliminer le dioxyde de carbone). Pour ce faire, on peut soit élever la température de la solution, le dioxyde de carbone étant moins soluble quand la température s'élève, soit diminuer la pression de l'air au-dessus de la solution, le dioxyde de carbone étant moins soluble quand la pression diminue.
|
|||||
| |
La fermentation malolactique se poursuit dans la bouteille fermée. Le gaz carbonique sous pression, issu de cette fermentation ne pouvant s'échapper se dissout dans le vin. A l'ouverture de la bouteille le CO2 dissout est libéré sous forme de bulles. chromatographie utiliser une cuve à chromatographie contenant l'éluant sur quelques mm de hauteur. réaliser les dépôts à l'aide d'une micropipette sur la ligne de dépôt. sortir le support papier lorsque l'éluant atteint la ligne supérieure sécher puis révéler. le vin A contient les 3 acides malique,lactique et tartrique : la fermentation malolactique n'est pas terminée. le vin B ne contient plus d'acide malique :mais de l'acide lactique la fermentation malolactique est terminée. le vin C contient de l'acide malique, pas d'acide lactique : la fermentation malolactique n'a pas encore eu lieu. acidité totale du vin chauffage à reflux : chauffe ballon; colonne de Vigreux ; ballon HA+HO- donne A- + H2O. constante Kr : H2O / HO- pka=14 HA / A- pka = 4,1 on met en présence l'acide le plus fort AH et la base la plus forte HO- et la différence des pKa est de 9,9 : une réaction naturelle se produit avec une constante de réaction Kr = 109,9 . La réaction de dosage est totale. dosage : lecture graphique : le volume de soude est voisin de 12 mL soit 12*0,1 = 1,2 mmol de soude donc 1,2 mmol d'acide contenu dans 20 mL de vin acidité totale du vin : 1,2 /0,020 = 60 mmol /L de vin La norme est dépassée, le vin n'est pas commercialisable.
|
||||||
|
|
|