| |
le jus
de citron En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
||||||
| |
|
||||||
|
|
fonctions dosage redox |
potentiel redox en volt : I2 / I- 0,62V ; C6H6O6 / C6H8O6 0,39V S4O62- / S2O32- 0,09 V C6H12O7 / C6H12O6 -0,24V L'oxydation du glucose par le diiode s'effectue à pH>7 et à pH<3 cette réaction est très lente.
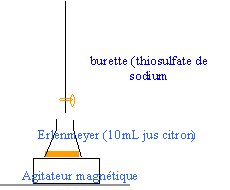
On préléve 10 mL de S que l'on place dans un erlenmeyer, on y ajoute 20 mL d'une solution aqueuse de diiode à 3,5 10-3 molL-1 . On laisse agir quelques minutes : on rèalise ainsi l'oxydation de l'acide ascorbique par le diiode . Le mélange garde une teinte brune.. A l'aide d'une burette, on verse dans l'erlenmeyer une solution aqueuse de thiosulfate de sodium à 5 10-3 mol L-1 . Quand la coloration brune commence à palir, on ajoute au contenu de l'erlenmeyer quelques gouttes d'empois d'amidon, la solution devient bleue puisqu'il reste du diiode en solution . On continue à verser la solution aqueuse de thiosulfate de sodium jusqu' à décoloration de la solution contenue dans l'erlenmeyer. Le volume ajouté est 11,2 mL.
exploitation des résultats
|
|||||
| |
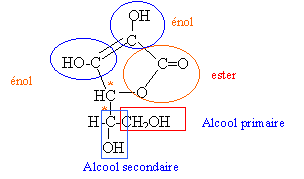
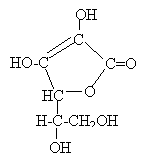
carbone asymétrique : carbone tétragonal lié à 4 groupes différents. le diiode oxyde l'acide ascorbique. A pH=2 , l'oxydation du glucose est très lente I2+2e- donne 2I- réduction C6H8O6 donne C6H6O6 +2H+ +2e- oxydation C6H8O6 + I2 donne C6H6O6 +2H+ +2I- (1). l'empois d'amidon joue le rôle d'indicateur de fin de réaction.
la couleur brune indique un excès de diiode. ce dosage s'effectue en 2 étapes (1) oxydation acide ascorbique par un excès de diiode (2) dosage deI2 en excès par le thiosulfate de sodium I2+2e- donne 2I- réduction 2S2O32- donne S4O62- +2e- oxydation 2 S2O32- + I2 donne S4O62- +2I- (2). quantité de matière I2 : initiale : 20 * 3,5 = 70 mmol ayant réagi avec le thiosulfate : 11,2*5 = 56 mmol thiosulfate donc 28 m mol I2 en excès. diiode ayant réagi avec l'acide ascorbique : 70-28 = 42 m mol donc d'après (1) : 42 m mol d'acide ascorbique dans 10 mL de jus [acide ascorbique] = 42 10-3/10 = 4,2 0-3 mol/L masse molaire acide ascorbique : 12*6+8+6*16= 176 g/mol masse d'acide ascorbique par litre de jus : 4,2 10-3 *176 = 0,74 g /L ou 74 mg dans 100mL issu du jus de citron |
||||||
|
|
|