| |
les eaux minérales ( bac juin 2000) En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
tests d'ions |
On se propose, au cours d'une séance d'activités expérimentales, d'identifier trois eaux minérales et de réaliser le dosage des ions chlorures d'une des eaux minérales.Les tests, utilisés dans la question 1, permettant l'identification des ions chlorure, sulfate, hydrogénocarbonate (ou bicarbonate) et calcium, présents en concentration suffisante, sont donnés dans le tableau suivant :
Couples acide-base : CO2,H2O / HCO3 - : pKa1 = 6,2 ;HCO3 - / CO3 2- : pKa2 = 10,2. Le tableau ci-dessous donne, pour trois eaux minérales, la concentration massique volumique exprimée en mg/L pour les ions étudiés ainsi que le pH de l'eau (indications lues sur les étiquettes).
Lors de la séance d'activités expérimentales, on dispose de trois flacons identifiés A, B et C, et contenant chacun l'une des eaux minérales du tableau n° II. On se propose de retrouver, pour chaque flacon, l'eau minérale qu'il contient. Pour cela on effectue différents tests pour chacune des eaux contenues dans les flacons. Les tests sont réalisés en prenant 3 mL d'eau minérale et 1 mL de réactif. Les résultats obtenus sont consignés dans le tableau suivant :
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |
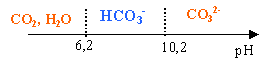
L'ion carbonate CO32- prédomine à pH supérieur à 10,2 ; à pH voisin de 7 , ce dernier est ultra minoritaire. HCO3- + H3O+ donne CO2 + 2H2O gaz formé : dioxyde de carbone. Le flacon A contient : des ions sulfates mais pas d'ion chlorures (disparition du précipité blanc lors de l'ajout d'acide nitrique) des ions hydrogénocarbonate (dégagement CO2) des ions calcium (précipité d'oxalate de calcium) eau minérale n°1 Le flacon B contient : des ions sulfates et des ions chlorures (maintient d'un précipité blanc lors de l'ajout d'acide nitrique) pas ou peu d'ions hydrogénocarbonate (pas de dégagement CO2 visible) des ions calcium (précipité important d'oxalate de calcium) eau minérale n° 3.
Le flacon C contient : des ion chlorures (maintient d'un précipité blanc lors de l'ajout d'acide nitrique) pas ou peu d'ions sulfate (pas de précipité visible BaSO4) pas ou peu d'ions hydrogénocarbonate (pas de dégagement CO2 visible) pas ou peu d'ions calcium (pas de précipité visible d'oxalate de calcium) eau minérale n° 2.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
dosage des ions chlorures |
Ecrire l'équation-bilan de la réaction donnant le précipité blanc. Déterminer la concentration massique volumique des ions chlorure dans l'eau n° 3. corrigé |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |
Ag+ + Cl- donne AgCl solide blanc. A l'équivalence : Quantité de matière d'ion Ag+ = Quantité de matière d'ion Cl-. 0,0133*2,5 10-2= 0,05*[Cl-] [Cl-] = 6,65 10-3 mol L-1. concentration massique : 35,5*6,65 10-3 = 236 mg L-1.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|