| |
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
||||||
| |
|
||||||
|
|
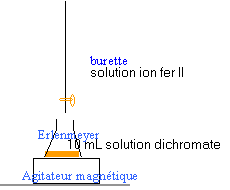
oxydation alcool dosage ion dichromate par les ions fe II |
Afin de déterminer avec précision l'alcoolémie d'un conducteur ayant provoqué un accident, il faut doser l'éthanol effectivement présent dans son sang. Pour cela, on procède à la prise de sang qui, soumise à une opération adéquate, conduit à une solution aqueuse d'éthanol ayant la même concentration que le sang. L'éthanol est dosé à l'aide d'une solution de dichromate de potassium en milieu acide. Cette solution oxydante est utilisée en excès par rapport à l'éthanol. Tout l'alcool est alors oxydé en acide. L'excès d'ions dichromate est dosé par une solution de sulfate de fer (II).
Données : E°(Fe3+/Fe2+) = 0,77V ; E°(Cr2O72-/Cr3+) = 1,33V
|
|||||
| . . | |||||||
| |
Cr2O72-+ 14H+ + 6 e- donne 2Cr3+ + 7H2O réduction Cr2O72-+ 14H+ +6Fe2+ donne 6Fe3+ + 2Cr3+ + 7H2O
à l'équivalence les quantités de réactifs sont proportionnelles aux coefficients de l'équation bilan. les ion dichromates sont jaunes orangés, lesions Cr3+ sont verts assez foncé: l'équivalence est observable. à une mole d'ion dichromate correspond 6 mol d'ion fer II. Qté de matière ion dichromate : 10 10-3 C Qté de matière d'ion fer II : 11,76 10-3 [Fe2+] = 6* 10 10-3 C [Fe2+] =60 /11,76 C= 5,1 C = 5,1*0,04 =0,204 mol /L. Qté de matière d'ion fer II : 17,65* 0,204 =3,6 mmol Qté de matière ion dichromate en excès : 3,6 / 6 =0,6 mmol Qté initiale ion dichromate : 0,04*20 = 0,8 mmol soit 0,2 mmol ion dichromate a oxydé l'alcool en acide éthanoïque. 3 fois{C2H6O + H2O donne C2H4O2 + 4H+ + 4e-}oxydation 2 fois{ Cr2O72-+ 14H+ + 6 e- donne 2Cr3+ + 7H2O } réduction 2Cr2O72-+ 16H+ +3C2H6O donne 3C2H4O2 + 4Cr3+ + 11H2O à 1 mol d'ion dichromate correspond 1,5 mol d'alcool à 0,2 mmol ion dichromate correspond donc 0,3 mmol éthanol 0,3 mmol éthanol dans 10 mL [éthanol] = 0,3 / 10 = 0,03 mol/L masse molaire éthanol : 2*12+6+16 = 46 g/mol titre = 0,03* 46 = 1,38 g /L on marche à pied et on laisse la voiture.
|
||||||
|
|
|
||||||