| |
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
||||||||||
| |
|
||||||||||
|
|
fonctionnement d'une pile, f.e.m |
corrigé |
|||||||||
| |
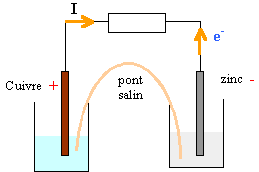
réaction naturelle entre le réducteur le plus fort et l'oxydant le plus fort. Le zinc métal le plus réducteur s'oxyde et libère des électrons Zn --> Zn2+ + 2e-. Les ions Cu2+, oxydant le plus fort se réduisent Cu2+ + 2e- --> Cu bilan : Zn +Cu2+ --> Zn2+ +Cu la f.e m est positive E= 0,34-(-0,76)=1,1 V E= EAg+/Ag - EM2+/M = 2 V EM2+/M = 0,8-2 = -1,2 V
|
||||||||||
| .
. |
|||||||||||
|
variation de masse des électrodes |
Ag+/Ag E=0,8 V ; Ni2+/Ni E= -0,23 V ; Ag=108 Ni=58,7 g mol-1. corrigé |
||||||||||
| |
oxydation du réducteur le plus fort Ni --> Ni2+ + 2e-. réduction de l'oxydant le plus fort 2 fois{Ag+ + e- --> Ag} Ni + 2Ag+ --> Ni2+ + 2Ag La charge d'une mole d'électrons est 96 500 C 9650 / 96500 = 0,1 mol d'électrons donc 0,05 mol (soit diminution de 2,9 g) de nickel s'oxyde et 0,1 mol (10,8 g) d'argent apparaît. Q(coulomb) = I (A) * t(s) t=7200 s I= 9650 / 7200 = 1,34 A
|
||||||||||
|
variation de masse des électrodes |
Une pile Cu Zn dans les conditions normales a une de ces électrodes qui augmente de masse de 63,5 mg en 15 min. Calculer la variation de masse de l'autre électrode et l'intensité du courant. corrigé |
||||||||||
| |
Cu2+ + 2e- --> Cu apparition d'un dépot de cuivre bilan : Zn +Cu2+ --> Zn2+ +Cu 0,0635 / 63,5 =10-3 mol de cuivre donc 10-3 mol de zinc ou 65,4 mg disparaît à 1 mmol de zinc correspond 2 mmol d'électrons. La charge d'une mole d'électrons est 96 500 C donc 96500*0,002 = 163 C 15 min = 15*60 =900 s I= 163 / 900 =0,181 A
|
||||||||||
|
durée de vie d'une pile |
corrigé |
||||||||||
| |
Cu2+ + 2e- --> Cu apparition d'un dépot de cuivre bilan : Zn +Cu2+ --> Zn2+ +Cu il faut compenser la disparition du métal zinc (augmenter la masse de la lame de zinc) il faut compenser la disparition des ions Cu2+ (augmenter la concentration en sulfate de cuivre) Placer du sulfate de cuivre en excès dans la solution de la cellule Zn2+ /Zn conduirait à la réduction de Cu2+ à la surface du zinc et à l'oxydation du zinc . Les électrons ne circuleraient pas dans le circuit extérieur. |
||||||||||
| |
|
||||||||||
|
pile cadmium argent |
La pile : Cd / Cd2+ ;0.1mol.L-1 // Ag+ ;0.1mol.L-1 / Ag debite dans un circuit fermé. La partie immergée de l'électrode de cadmium a une masse de 5 g. La capacite massique de l'electrode de cadminium est de 477 Ah.kg-1.
corrigé |
||||||||||
| |
1 Ah=3600 C 2,385*3600= 8586 coulombs quantité de matière d'électrons : La charge d'une mole d'électrons est 96500 C. 8586 / 96500 = 89 mmol d'électrons volume de la solution d'ion argent : Réduction des ions argent : Ag+ + e- donne Ag à 1 mol d'électron correspond une mole d'ion argent 0,089 / 0,1 = 0,89 L |
||||||||||
|
pile fer aluminium |
On fabrique une pile par association de 2 demi-piles :Fe2+/Fe et Al3+/Al. La pile débite un courrant I=12mA pendant 45mn.
Données : E°(Fe2+/Fe)=-0,44V ; E°(Al3+/Al)=-1,66V ;M(Fe)=56g.mol-1 corrigé |
||||||||||
| |
quantité d'électricité : intensité (A) * durée (s) 0,012*45*60 = 32,4 C quantité de matière d'électrons : La charge d'une mole d'électrons est 96500 C. 32,4 / 96500 = 3,36 10-4 mol d'électrons masse de fer déposé : Réduction des ions fer II : Fe2+ + 2e- donne Fe 3,36 10-4 / 2 = 1,68 10-4 mol de fer 3,36 10-4 *56= 9,4 mg de fer.
|
||||||||||
|
pile aluminium cuivre |
Al=27 ; Cu=63,5 g mol-1. corrigé |
||||||||||
| |
fem = potentiel de la borne positive - potentiel de la borne négative. La f.e.m est toujours positive. 2 = 0,34 - E(Al3+/Al) 0,34-2 = - 1,66 V réaction de fonctionnement de la pile 2Al + 3Cu2+ donne 2Al3+ + 3 Cu la masse de cuivre augmente de 0,45 g soit 0,45 / 63,5 = 7,08 mmol
soit 4,72 10-3*27 = 0,127 g durée de fonctionnement : Cu2+ + 2 electrons donne Cu soit 7,08*2 =14,16 mmol d'électrons La charge d'une mole d'électrons est 96500 C. 0,01416*96500= 1366 coulombs Q (C)= I(A)*t(s) 1366 = 0,5 Dt durée =2733 s.
|
||||||||||
|
pile zinc cuivre |
On realise une pile cuivre-zinc.Les solutions ont une concentrations C=0,1mol.L-1 et un volume 200mL. L'electrode zinc est une tige de masse 1g dont la moitié plonge dans la solution de sulfate de zinc.
corrigé |
||||||||||
| |
le zinc, réducteur le plus fort s'oxyde et constitue la borne négative Cu2+ + Zn donne Zn2+ + Cu la pile est usée dés que l'un au moins des réactifs a disparu. ion cuivre (au départ )Cu2+ : 0,1*0,2 =0,02 mol zinc métal : 0,5 / 65,4 = 0,0076 mol c'est le réactif limitant alors que les ions Cu2+ sont en excès. concentration finale des solutions : ion Zn2+ formé : 0,0076 mol dans 200 mL au départ : 0,1*0,2 =0,02 mol dans 200mL [ Zn2+ ] =(0,02+0,0076) / 0,2 = 0,138 mol L-1. disparition 0,0076 mol ion cuivre Cu2+ il en reste 0,02-0,0076 mol dans 200 mL [ Cu2+ ] =(0,02-0,0076) / 0,2 = 0,062 mol L-1. masse des électrodes : tout le zinc a disparu : la pile est usée formation de 0,0076 mol cuivre métal 0,0076*63,5 = 0,48 g |
||||||||||
|
|
|||||||||||