|
d'après concours kiné Paris 2000
|
|||||||||||||||||||||
|
saponification |
Soit une solution alcoolique de volume V=500 mL contenant 0,2 mol de palmitine et 0,6 mol d'hydroxyde de potassium (KOH) à l'instant t=0. La température du système est 40°C. Soit x la concentration de la palmitine restant à la date t.
palmitine : triester obtenu à partir du propan-1,2,3-triol et de l'acide palmitique C15 H31 COOH. indice d'ester : masse de potasse exprimée en mg nécessaire pour saponifier une masse de 1g de corps gras. masse molaire g/mol : palmitine : 806 ; potasse : 56,1. corrigé |
||||||||||||||||||||
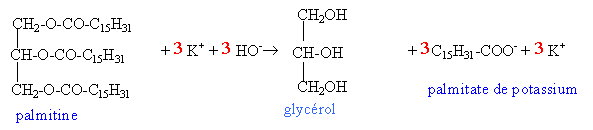
saponification : réaction lente mais totale.
à t½ la moitié du réactif limitant a disparu. dans ce cas les réactifs sont en proportion stoéchiomètriques t½ = 0,1 mol de palmitine. vitesse moyenne de formation du savon : 6 Dx /Dt = 6* 0,1 / 10 = 0,06 mol L-1 min-1. indice d'ester : Qté de matière de palmitine dans 1g : 1/ 806 = 1,24 mmol Qté de matière de potasse : 3* 1,24 = 3,72 mmol masse de potasse : 3,72 * 56,1 = 208 mg de potasse.
|
|||||||||||||||||||||
|
acide base |
Soit la solution aqueuse de volume 1L contenant initialement 0,1 mol de fluorure de potassium KF et 0,2 mol de nitrate d'ammonium NH4NO3.
corrigé |
||||||||||||||||||||
|
NH4+ / NH3 : pKa = 9,2 HF/ F- pKa = 3,2 H3O+ / H2O pKa= 0 l'ion ammonium est l'acide faible le plus fort en solution et l'ion fluorure est la base faible la plus forte présente en solution NH4+ + F- en équilibre avec NH3 + HF [NH3] [HF] /([NH4+] [F-] )=[NH3] [H3O+][HF] /([NH4+] [F-][H3O+] ) Kr = 10-9,2 /
10-3,2 = 10 -6 , réaction
très partielle.
10-6 *(0,2-b)(0,1-b)= b² -0,3 10-6 b+2 10-8 voisin de b² b² + 0,3 10-6 b-2 10-8 =0 D = 9 10-14 + 8 10-8 d'où b voisin de 1,41 10-4 mol par suite : [NH4+] = 0,2-1,41 10-4 = 0,19986 mol/ L. [F-] = 0,1 -1,41 10-4 = 0,09986 mol/ L. [HF] = [NH3] = 1,41 10-4 mol/L [K+]=0,1 mol / L inchangée [NO3-]=0,1 mol /L inchangée la solution reste électriquement neutre: [NO3-] + [HO-] + [F-] = [NH4+] +[K+] +[H3O+] 0,2 + 10-14 / [H3O+] +0,1- b = 0,2 -b + 0,1 + [H3O+] [H3O+]² = 10-14. d'où pH =7 à 25°C |