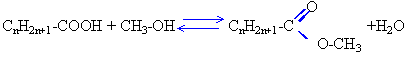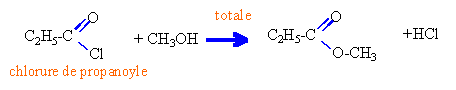|
|
|
|
oxydation ménagée des alcools |
En vue de déterminer les proportions relatives d'alcools primaire et secondaire contenus dans un mélange de butanols on réalise l'oxydation de 1,8 g de ce mélange par un excès de dichromate de potassium en milieu acide.On rappelle le couple redox de l'ion dichromate Cr2O72- /Cr3+.
corrigé |
|
l'alcool secondaire (butan-2-ol) conduit à une cétone (butanone) Cr2O72- + 14 H+ + 6 e- -->2Cr3+ + 7H2O réduction.(1) C4H10O +H2O --> C4H8O2 +4H+ +4e- oxydation en acide.(2) C4H10O --> C4H8O +2H+ +2e- oxydation en cétone.(3) 2 fois (1) + 3 fois (2 ) donne : 2Cr2O72- + 16 H+ +3C4H10O --> 4Cr3+ + 3C4H8O2 + 11H2O (1) + 3 fois (3) donne : Cr2O72- + 8 H+ +3C4H10O --> 2Cr3+ + 3C4H8O2 + 7H2O La D.N.P.H réagit avec la cétone, mole à mole à 0,015 mol de cétone correspond donc 0,015 mol de butan-2-ol. ou bien en masse 0,015*74 = 1,11 g Quantité de matière d'alcools dans le mélange : 1,8 /( 4*12+10+16)=0,0243 mol soit 9,3 10-3 mol de butan-1-ol ou bien en masse 9,3 10-3 *74 = 0,69 g
|
|
|
mélange d'acide + soude |
On dissout dans l'eau, de manière à obtenir 1 L de solution :
corrigé |
|
conservation de la matière de l'élément carbone. [FCOOH]+[FCOO-] =1 (1) pH d'une solution contenant un couple acide base . pKa = 10-pKa = 4,7 pH = pKa + log[FCOO-] /[FCOOH] log[FCOO-] /[FCOOH] = 4,25 - 4,7 = -0,45 [FCOO-] /[FCOOH] = 10 -0,45 = 0,355 (2) résoudre ces 2 équations [FCOO-] = 0,355 [FCOOH] 0,355 [FCOOH] +[FCOOH] =1 [FCOO-] = 0,26 mol/L et [FCOOH]= 0,74 mol / L. la solution reste électriquement neutre : [Na+] + [H3O+]=[HO-]+[HCOO-]+[FCOO-] [H3O+] et [HO-] sont négligeables devant les autres espèces. [Na+] =1 mol /L d'où [HCOO-] = 0,74 mol/L en conséquence [HCOOH]=0,26 mol/L [H3O+] =10 -4,25 = 5,6 10-5 mol /L [HO-] = 10-14 /10 -4,25 = 1,78 10-10 mol/L pKa du couple HCOOH / HCOO-. pH = pKa + log[HCOO-] /[HCOOH] pKa = 4,25 - log (0,74 /0,26 )= 3,8 à concentration égale, l'acide faible le plus fort a le plus petit pKa. L'acide formique est plus fort que l'acide benzoïque. |
|
|
chimie organique dérivés oxygénés |
A désigne un monoacide carbonique à chaîne saturée.
corrigé |
|
CH3-OH méthanol, alcool primaire
88 = 12(n+1)+2*16+3+2n+1 d'où n= 2 l'acide de départ est l'acide propanoïque.
avec le chlorure d'acyle, la réaction avec l'alcool est totale, rapide et exothermique alors qu'avec l'acide propanoïque l'estérification était lente, athermique et limitée. 4,4 /88 = 0,05 mol d'ester, donc 0,05 mol d'alcool et 0,05 mol de chlorure de propanoyle. et en masse : alcool :0,05 *(12+4+16 )= 1,6 g chlorure de propanoyle : 0,05 *(3*12+35,5+5+16)= 4,62 g chlorure d'hydrogène :0,05 mol soit 0,05*36,5 =1,82 g soit 24*0,05 =1,2 L par oxydation ménagée du propan-1-ol on obtient l'acide propanoïque. |