l'ion éthanolate formé réagit avec
l'eau ( réaction 2) pour donner l'éthanol et
des ions HO-.
Dans 20 mL d'éthanol on introduit 1 g de sodium :
une réaction exothermique se produit
accompagnée d'un dégagement gazeux important.
Quand tout le sodium a disparu, on refroidit le
mélage qu'on introduit dans une fiole jaugée
de 200 mL contenant un peu d'eau distillée. On
complète jusqu'au trait de jauge avec de l'eau
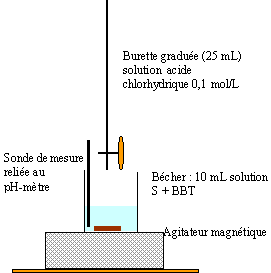
distillée et on obtient la solution S. On dose 10 mL
de S par une solution d'acide chlorhydrique à 0,1
mol/L.
masse atomique molaire (g/mol) : C=12 ; H=1 ; O=16 ; Na
=23.
corrigé
la réaction 1 n'est pas une réaction
acide-base car il n'y a qu'un seul couple acide base
C2H5OH /
C2H5O- mis en jeu.
il s'agit d'une réaction d'oxydo-réduction,
le sodium est le réducteur.
Quantité de matière (mmol) :
sodium : 1/23 = 0,0435 mol = 43,5 mmol
éthanol : masse = 20 *0,79 =15,8 g
15,8 / 46 =0,343 mol = 343 mmol (excès d'environ
300 mmol)
il se forme 43,5 mmol d'ion éthanolate.
base forte :
espèce, ion ou molécule susceptible de
gagner un proton H+.
entièrement ionisée dans l'eau; la
réaction d'une base forte avec l'eau est totale.
C2H5O- + H2O
--> C2H5OH + HO-.
deux couples acides bases sont mis en jeu :
C2H5OH /
C2H5O- et H2O /
HO-.
dosage :
l'équivalence peut être
repérée à l'aide d'un indicateur
coloré dont la zone de virage contient le pH à
l'équivalence. dosage acide fort base forte :
pHéqui = 7 ; indicateur : bleu de
bromothymol.
HO- + H3O+ -->
2H2O
à l'équivalence acide base : CaVa =
CbVb
CaVa = 21,6 *0,1 = 2,16 mmol d'ion HO- dans 10
mL de S
soit 2,16*20 = 43,2 mmol ion HO- ( donc d'ion
éthanolate) dans 200 mL de S.
retour - menu