- On dispose d'un litre de solution acidifiée de permanganate de potassium deconcentration C1 = 0,010 mol.L -1 pour réaliser un dosage.
- Quelle masse de permanganate de potassium solide a-t-on utilisé pour préparer 0,50 L de cette solution ?
- Quel acide utilise-t-on pour acidifier cette solution ?
- Cette solution acidifiée de permanganate de potassium est utilisée pour doser une solution de sulfate de fer (II). La prise d’essai de cette solution de sulfate de fer (II) est V2 = 20 mL. Faire un schéma annoté du dispositif expérimental (matériel et solutions).
- Ecrire les demi-équations électroniques et l’équation-bilan de la réaction d’oxydoréduction.
- Préciser les couleurs des réactifs et des produits de la réaction. En déduire comment on repère l’équivalence.
- On a versé V1 = 15 mL de solution
de permanganate de potassium pour doser la solution de
sulfate de fer (II). En déduire la concentration
C2 de cette solution.
Données :
Masses molaires atomiques en g.mol -1 : K = 39 ;Mn = 55 ; O = 16
Couples oxydoréducteurs : Fe 3+ /Fe 2+ : E°1 = 0,68 V ; MnO4 - /Mn 2+ : E°2 = 1,51 V
corrigé
0,005*(39+55+4*16)=0,79 g
acidifié par l'acide sulfurique
la burette contient le permanganate de potassium.
l'erlenmeyer, placé sur agitateur magnétique contient la prise de 20 mL de sulfate de fer.
Seul l'ion permanganate est coloré (violet), il est à la fois réactif et indicateur de fin de réaction.
MnO4- +5 e- + 8H+ --> Mn2+ + 4H2O réduction
5{ Fe2+ --> Fe3+ + e- } oxydation
MnO4- + 8 H+ + 5 Fe2+ --> 5 Fe3+ + Mn2+ + 4 H2O
Quantité de matière de permanganate : 15*0,01 = 0,15 mmol à l'équivalence
donc 0,15*5=0,75 mmol d'ion Fe2+.
0,75 = 20 C2.
C2 = 0,0375 mol L-1.
Sur l'étiquette de la bouteille contenant une solution commerciale d'acide sulfurique, on relève les indications suivantes:
- Donner la formule de l'acide sulfurique. Calculer sa masse molaire moléculaire.
- Calculer la concentration molaire en acide sulfurique de la solution commerciale.
- Un professeur a besoin, pour des expériences de cours en classe de 1ère S, de 250 mL d’une solution diluée d’acide sulfurique à 2,5 mol.L -1 . Calculer le volume de solution commerciale à prélever.
- A l’aide de schémas annotés, préciser le protocole à suivre pour réaliser cette dilution ; on indiquera les précautions à prendre. Proposer le titre de la leçon traitée par le professeur.
Masses molaires atomiques en g.mol -1 : H = 1 ; O = 16 ; S = 32
Masse volumique de l’eau : ? 1 000 g.L -1
corrigé
1840 *0,95 =1748 g d'acide pur par litre
1748 / 98 = 17,8 mol L-1.
volume pipette(mL)* concentration de la solution mère = volume fiole jaugée (mL) * concentration finale
volume pipette = 250*2,5 /17,8 = 35,1 mL
prélever 35,1 mL à la pipette
placer dans fiole jaugée de 250 mL
compléter avec de l'eau distillée.
titre : concentration et dilution
- On veut étudier quatre composés
organiques A, B, C, D:
A est de l'éthanal, B est de la propanone, C est du propan-1-ol, D est du méthylpropan-2-ol.
- Donner la formule semi-développée et la fonction chimique de chacun de ces composés ainsi que la classe de C et D.
- On fait différents tests sur chacun d'eux. compléter le tableau en écrivant A, ou B ...(la bonne réponse) dans le tableau suivant :
|
|
|
|
|
|
|
3. Décrire le mode opératoire du test à la D.N.P.H. ; qu'observe-t-on si le test est positif ?
4. Décrire le mode opératoire du test au réactif (ou liqueur) de Fehling ; qu'observe-t-on si le test est positif ?
5. Réaction avec le « réactif de Tollens » ou nitrate d’argent ammoniacal :
- a) Des quatre composés
précédents, quel est celui qui
réagit avec le réactif de Tollens ?
b) Comment prépare-t-on la solution appelée « réactif de Tollens » ?
(mode opératoire, solutions à utiliser ; aucune valeur numérique n’est demandée)
c) Qu’observe-t-on si le test au réactif de Tollens est positif ? En déduire le nom habituel de cette expérience.
d) Sur le plan de la sécurité, quelle précaution particulière faut-il prendre à propos du réactif de Tollens ?
corrigé
|
|
|
|
|
|
|
|
alcool tertiaire |
groupe carbonyle |
alcool |
aldehyde |
C et D alcool |
alcool primaire |
ajouter quelques gouttes d'aldehyde ou de cétone à 1 mL de DNPHd ans un tube à essais :
formation d'un solide jaune en présence du groupe carbonyle >C=O.
En présence d'un aldehyde réducteur :
vers 50 ° C, la liqueur de Fehling bleue donne un solide rouge brique Cu2O.
le réactif de Tollens donne un miroir d'argent sur le tube à essais.
réduction de[Ag(NH3)2]+ ion diammine argent présent dans le réactif de Tollens en argent par un aldehyde.
ajouter de l'ammoniaque à une solution de nitrate d'argent à raison de 2 moles d'ammoniaque pour une mole de nitrate d'argent. L'ammoniaque est irritant , travailler sous hotte.
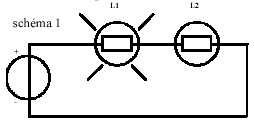
- Deux lampes de 6V, L1 et L2,
sont branchées comme l’indique le
schéma 1 ; L1 brille, L2 ne
brille pas.
Parmi les affirmations suivantes, indiquer par celles qui sont Vraies et celles qui sont Fausses.
L2 est grillée ; L1 et L2 sont traversées par un courant de même intensité
L1 et L2 n'ont pas la même puissance ; L1 est plus puissante que L2 ; L2 est plus puissante que L1
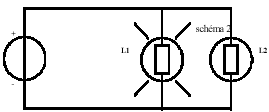
- Deux lampes de 6V, L1 et L2 ,
sont branchées comme l’indique le
schéma 2 ; L1brille, L2 ne
brille pas.
Parmi les affirmations suivantes, indiquez par un V celles qui sont Vraies par un F celles qui sont Fausses.
L2 est grillée ; L1 et L2 sont traversées par un courant de même intensité
L1 et L2 ont la même tension à leurs bornes
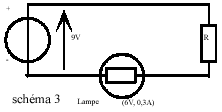
- Dans le circuit suivant (schéma 3), quelle
résistance (ou conducteur ohmique
ourésistor) R peut-on brancher en série
avec la lampe pour que celle-ci ne soit pas
détériorée et brille normalement.
Un conducteur ohmique (5, 0,5 W); Un conducteur ohmique (10, 0,5 W)
Un conducteur ohmique (10, 1 W) ;Un conducteur ohmique (50, 1 W)
corrigé
dans un circuit série tous les appareils sont traversés par la même intensité.
L1 est plus puissance
que la seconde lampe (vrai)
schéma 2: L2 est grillée
(vrai)
L1 et L2 ont la même tension
à leurs bornes (vrai)
schéma 3: aux bornes du conducteur ohmique, la
tension doit être de 3 V.
L'intensité dans le circuit doit être 0,3 A
d'où R = 3 / 0,3=10 ohms
puissance consommée par R : U²/R =3*3/10 =0,9W soit 1W.
A l'aide d'un montage potentiométrique, on établit la caractéristique U = f(I) d'une cuve à électrolyse (ou électrolyseur) contenant une solution aqueuse de soude. U désigne la tension aux bornes de la cuve à électrolyse et I l'intensité du courant continu qui la traverse.
- Etablir la liste du matériel nécessaire à la réalisation de l'expérience. Schématiser le montage.
- A l’aide du tableau de mesures suivantes, tracer
la caractéristique de la cuve à
électrolyse :
En exploitant le graphique :U en volt 1,8 2 2,6 3,2 I en mA 25 50 75 120 a) Donner la valeur de U quand I = 75 mA.
b) Déterminer la résistance interne r' de l'électrolyseur, ainsi que sa force contre-électromotrice E'.
Peut-on réaliser l'électrolyse avec cette cuve à électrolyse, si le générateur dans cette expérience est une pile de 1,5 volt ? Justifier la réponse.
corrigé
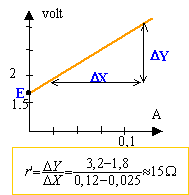
E' : ordonnée à l'origine soit voisin de1,7 V. La f.e.m de la pile doit être supérieure à E'.
r' : coefficient directeur de la droite
On veut étudier la réfraction de la lumière par le dioptre plan air / altuglass.
- Décrire le dispositif utilisé en travaux pratiques qui permet cette étude et justifier la forme donnée au bloc d'altuglass.
- On a mesuré les valeurs de l'angle d'incidence i ( dans l'air ), et de l'angle de réfraction r ( dans l'altuglass ) :
|
|
|
|
|
|
|
|
|
|
|
|
a) Dans le cas où i = 40°, faire un schéma montrant le rayon incident et le rayon réfracté en indiquant les angles d'incidence et de réfraction.
b) Montrer que les valeurs de i et de r vérifient la loi de la réfraction.
c) En déduire l'indice de réfraction de l'altuglass par rapport à l'air.
d) Calculer la valeur de l'angle de réfraction limite du dioptre air /altuglass.
corrigé
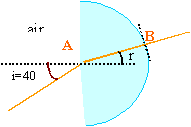
en B le rayon lumineux est perpendiculaire à la surface de séparation air / altuglas, donc il n'y a pas de déviation.
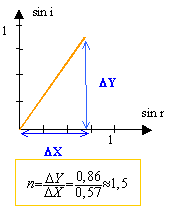
Le graphe étant une droite, sin i et sin r sont proportionnels : la loi de Descartes concernant la réfraction est vérifiée.
sin i = n sin r, avec n coef directeur de la droite.
angle de réfraction limite : sini =sin 90 =1
sin r =1 / n = 1/ 1,5 = 0,666 et rlimite = 42 °.
Dans l’expérience d'optique représentée ci-dessous, on forme sur un écran, à l’aide d’une lentille de distance focale f’, l’image d'un objet constitué d'une lettre F éclairée par une source lumineuse. Sur le banc optique, on mesure la distance d entre l’objet et l’écran ; on trouve d = 80 cm. On constate que la taille de l’image est égale à celle de l’objet.
- Légender la représentation ci-dessous et préciser la nature de la lentille.
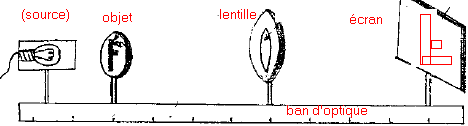
- Représenter sur le dessin l'image de la lettre F telle qu'elle apparaît sur l'écran.
- Déterminer le grandissement. Donner les valeurs numériques des distances objet/lentille et lentille/écran.
- Construire le schéma optique conventionnel donnant l’image de l’objet F représenté par une flèche. On placera les points caractéristiques de la lentille et on représentera 3 rayons caractéristiques.
- Déterminer la distance focale de la lentille (méthode graphique conseillée, à défaut par le calcul).
- Comparer le résultat avec l’indication + 5 portée par la lentille. Préciser avec quelle unité (nom et symbole) est exprimé + 5.
- On accole à la lentille précédente un miroir plan. On approche l'objet de la lentille depuis une position éloignée jusqu'à ce que l'image et l'objet aient la même taille. Dans ce cas, où se forme l'image ? Que valent les distances objet-lentille et lentille-image ?
- Préciser le nom de cette méthode qui en pratique sert à déterminer les distances focales.
corrigé
grandissement g = -1 , image renversée, même taille que l'objet.
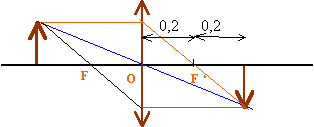
la distance focale vaut 0,2 m . La vergence est 1 / 0,2 =5 (d) dioptries.
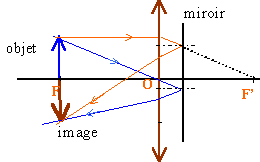
méthode autocollimation :
si l'objet est au foyer objet, l'image se forme dans le plan de l'objet, renversée et de même grandeur que l'objet.