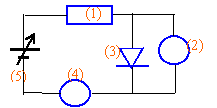
- Préciser le nom et la fonction de chacun des composants du montage ci dessous :
- Que permet de tracer ce montage ?
- Le dipôle (3) ne peut supporter plus de 100 mA.
Sachant que la tension maximale délivrée
par le dipôle (5) est de 15 V, calculer l'ordre de
grandeur de R pour que les 100 mA ne soient en aucun cas
dépassés.
corrigé
(2) voltmètre en dérivation
(3) diode ne laisse passer le courant que dans un sens
(4) ampèremètre en série
(5) générateur de tension continue réglable
Ce montage permet de tracer la caractéritique courant tension de la diode.
loi d'Ohm : 15= R*0,1 d'où R=150 ohms (valeur minimale).
Avec quel appareil peut-on mesurer:
une pression
une résistance
un champ magnétique
une puissance électrique
corrigé
multimètre utilisé en ohmètre
teslamètre
wattmètre
nom de l'unité suivie du mot mètre
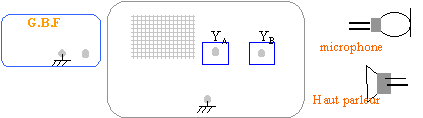
Indiquer les connexions à effectuer pour visualiser à l'oscilloscope les tensions aux bornes du générateur basse fréquence et aux bornes du microphone
corrigé
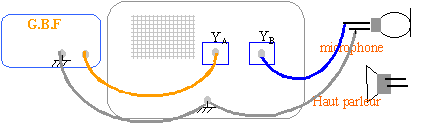
toutes les masses doivent être reliées ensemble.
sur la voie YA, on visualise la tension aux bornes du G.B.F
sur la voie YB, on visualise la tension aux bornes du microphone.
Quels éléments de verrerie utilisez-vous ?
Quelle est la valeur du coefficient de dilution souhaité ici ?
En déduire le volume v0 de solution mère à prélever.
Expliquer comment réaliser la préparation de la solution S1
Quelles sont les espèces présentes en solution S1 dans (noms et formules)
corrigé
Le volume à prélever est le1 / 100 du volume final 1L
Prélever 10 mL de la solution S0 avec une pipette surmontée d'un pipeteur.
introduire dans fiole jaugée de 1 L
compléter avec de l'eau distilée jusqu'au trait de jauge.
Les ions sodium Na+ et hydroxyde HO- sont présents dans la solution de soude.
- -Citer deux utilisations possibles des solutions tampon.
- Donner la couleur du bleu de bromothymol à pH=7
- Quelle est la couleur de l'hélianthine dans
une solution concentrée d'acide chlorhydrique ?
corrigé
conduire une réaction à pH fixé
bleu en milieu basique, vert à pH=7 et jaune en milieu acide
l'hélianthine est rouge en milieu acide chlorhydrique concentré.
- Nommer les composés dont les formules sont :
CH3CO2H ; FeSO4 ; C6H6 .; KMnO4
- Quel est le réactif des aldéhydes et des cétones ?
- Donner l'équation bilan de la réaction entre le zinc et une solution aqueuse d'acide chlorhydrique.
corrigé
La D.N.P.H (2,4-dinitrophénylhydrazine) donne avec les aldehydes et les cétones un solide jaune, une hydrazone.
Zn + 2 H3O+ + 2Cl- donnent Zn2+ + 2Cl- + H2 (gaz) + 2H2O