On dispose d'un produit détartrant pour WC ,le fabricant a indiqué:
- Attention contient 4,75% d'acide chlorhydrique .irritant pour les yeux et la peau.Ne pas laisser à la portée des enfants .Eviter le contact avec la peau ou les yeux...
- Quelle précaution doit on prendre pour manipuler ce produit ?
- On dilue 10 fois la solution commerciale afin d'obtenir 100 mL de solution de concentration Ca=0,1 molL-1. Quel matériel faut-il utiliser ?
- On dose 10 mL de la solution
diluée par une solution d'hydroxyde de sodium
à 0,1 molL-1
l'indicateur coloré utilisé change de teinte pour un volume Vb=13,1 mL. Quelle est la concentration initiale de la solution commerciale ?
- Le fabricant a t-il bien
annoté son étiquette.
H=1 ; Cl =35,5
gmol-1.
densité de la solution commerciale = 1 ; volume 1L
corrigé
dilution : prélever un volume V=10 mL de la solution mère à la pipette, puis placer dans une fiole jaugée de 100 mL , compléter à l'eau distilée.
dosage acide base : à l'équivalence CaVa=CbVb
Ca=0,1*13,1/10 = 0,131 molL-1.
la solution commerciale est 10 fois plus concentrée : 1,31 mol L-1.
densité= 1 signifie : la masse de 1 L de solution est 1000g
masse d'acide pur dans la solution du commerce : 1000*4,75/100= 47,5 g
Qté de matière d'acide en mol : 47,5 / (1+35,5) = 1,3 mol L-1.
étiquette exacte
On dose le composé chimique I avec le composé chimique II , indiquer dans le tableau suivant s'il s'agit d' un dosage d'oxydo-réduction ou acido-basique et noter l'indicateur de fin de réaction à employer si nécessaire
composé chimique I composé chimique II type de dosage indicateur de fin de réaction K+ OH- HCOOH MnO4- + H+ Fe 2+ I - S2O3 2- NH3 H3O + Cl -
corrigé
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Compléter le texte suivant, en ajoutant le nom du " degré " évoqué et à la suite la définition correspondante :
- Une eau de Javel à 12° c'est : ......................................................
- Un vinaigre à 6° c'est :...............................................................
Un lait à 15° c'est : ..................................................................................
corrigé
Un vinaigre à 6° d'acidité c'est la masse en grammes d'acide éthanoïque pur contenu dans 100 g de vinaigre.
Un lait à 15° Dornic c'est : 1,5 g d'acide lactique par litre de lait.
Pour préparer une séance de TP de cinétique chimique le professeur a besoin d'une solution d'eau oxygénée à 0,85 molL-1. Vous devez préparer cette solution à partir d'une solution commerciale à 110 volumes.
La concentration de H2O2 exprimée en volume est le nombre de litres de dioxygène gazeux à 0°C et 1 atm donné pour un litre de solution de H2O2 à 20°C suivant la réaction de dismutation :
H2O2 (liquide) donne H2O (liquide) + 0,5 O2 (gaz)
Volume molaire moléculaire : 22,4 Lmol-1.
- Quel volume de solution commerciale faut-il introduire dans une fiole jaugée de 0,5L
Citez deux domaines d'utilisation de l'eau oxygénée .
corrigé
Qté de matière O2 libérée par H2O2 à 110 volumes :110/22,4 = 4,91 mol de O2.
à partir d'une mole d'eau oxygénée on obtient 0,5 mol de dioxygène (coef équation)
à partir de
9,82
mol d'eau oxygénée on obtient 4,91 mol de
dioxygène
dilution
volume pipette (L)*concentration sol mère(molL-1)=volume fiole(L)*concentration finale
9,82 V = 0,5*0,85 ; V= 43 mL
antiseptique, blanchiment du papier, des textiles, traitement des eaux et effluents..
Soit la réaction suivante :
- Entourer dans la liste suivante le nom de cette réaction :
Estérification Saponification Hydrolyse Redox
Compléter le tableau suivant en donnant le nom ou la formule manquante butan-1-ol acide propanoïque CH3COCH3 CH3CONH2
corrigé
|
|
|
|
|
|
|
|
|
|
Le titre alcalimétrique complet TAC d'une eau c'est le volume d'acide à 0,02 molL-1 d'ions H30+ nécessaire pour doser 100 mL d'eau en présence de BCR : vert de bromocrésol - rhodamine.
- Compléter le texte suivant en donnant les noms de la verrerie utilisée pour le mode opératoire :
On mesure exactement 50 mL d'eau " X " avec une ........
On ajoute quelques gouttes de BCR.
On dose avec une solution d'acide chlorhydrique à 0,02 molL-1 contenue dans .........
On note le volume équivalent au virage de l'indicateur et on obtient les résultats suivants : eau du robinet Volvic Evian Volume équivalent mL 2,5 3 15 TAC
corrigé
On ajoute quelques gouttes de BCR.
On dose avec une solution d'acide chlorhydrique à 0,02 molL-1 contenue dans une burette graduée
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
- A - Sur les étiquettes
des flacons on peut lire
ACETONE ( propanone ) R : 11 ;S : 9-16-23-33 ; C ; F.
ACIDE PHOSPHORIQUE R : 34 ;S : 26-45 ; C ; F.
- Donner la signification des symboles et indications de danger.
- Pour l'emploi d'une substance comburante, vous devez :
- Éviter tout contact avec la peau et les yeux Vrai Faux
- Éviter tout contact avec les matières combustibles Vrai Faux
- Éviter les chocs, les flammes et les étincelles Vrai Faux
- Entourer la (ou les ) réponses qui vous paraissent correctes.
Remplacer chacun des solvants toxiques du tableau par l'un des solvants de remplacement suivants présentant une toxicité moindre : dichlorométhane, éthanol, toluène, cyclohexane. benzène chloroforme hexane méthanol
corrigé
Pour l'emploi d'une substance comburante, vous devez :
- Éviter tout contact avec
la peau et les yeux Faux
Éviter tout contact avec les matières combustibles Vrai
|
|
|
|
|
|
|
|
|
|
- Le sirop de menthe contient
deux colorants :
La tartrazine (E 102) et le bleu patenté (E 13 1) . Après avoir extrait les deux colorants du sirop, vous voulez les séparer en utilisant la technique de la C.C. M.
- Indiquer par une croix dans la
liste ci - dessous le matériel
nécessaire.
plaque pour chromato ; pipette pasteur; réfrigérant; éprouvette graduée; éluant; colorant jaune E 102; bécher; colorant bleu E 131; papier étirable; agitateur magnétique. Comment procédez - vous pour réaliser la chromatographie ?
Indiquer les positions des différentes taches à la fin de l'expérience.

corrigé
placer l'éluant dans le bécher ( hauteur 5 mm), mettre un couvercle.
sur la plaque CCM, tracer 2 traits au crayon de papier à 7 ou 8 mm des extrémités
sur le trait inférieur faire les dépots (pipette pasteur), sirop à analyser et colorants purs
placer dans le bécher, fermer, retirer dés que l'éluant atteint le trait supérieur.

- Dans la liste ci - dessous, indiquer par une croix
les réactifs nécessaires pour
réaliser une estérification.
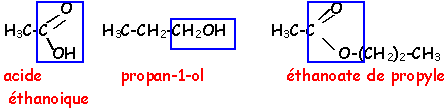
Propanone; acide éthanoïque; propan -1 -ol; ammoniac; propanal; éthylamine; propanoate d'éthyle; soude.
- Donner les formules semi - développées planes des réactifs choisis
Donner la formule semi - développée plane et le nom de l'ester obtenu.
corrigé
- Compléter en indiquant si les affirmations sont vraies (V) ou fausses (F).
- l'hélianthine est un indicateur coloré d'oxydo - réduction
- le nitrate d'ammonium est un engrais
- l'empois d'amidon donne une couleur bleue foncée en présence d'ions iodure ( I- )
- la phénolphtaléme est incolore en milieu acide
- une solution de permanganate de potassium est violette
- les aldéhydes et les cétones donnent un précipité jaune orangé avec la D.N.P.H.
- Compléter l'unité ou la grandeur
correspondante dans le tableau suivant :
g/L mol/L pression température absolue
corrigé
- l'hélianthine est un indicateur coloré d'oxydo - réduction faux acide base
- le nitrate d'ammonium est un engrais vrai
- l'empois d'amidon donne une couleur bleue foncée en présence d'ions iodure ( I- )vrai
- la phénolphtaléme est incolore en milieu acide vrai rose en milieu basique
- une solution de permanganate de potassium est violette vrai
- les aldéhydes et les cétones donnent un précipité jaune orangé avec la D.N.P.H. vrai
|
|
|
|
|
|
|
|
|
|