|
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. avec calculatrice |
||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
I- Identifier un indicateur coloré : on dispose d'un flacon d'indicateur coloré avec la seule indication c0= 2,9 10-4 mol/L. La mesure du pH donne 4,18. On en déduit [H3O+]=6,6 10-5 mol/L. Le couple acide base présent dans l'indicateur coloré est noté Hind / Ind-. La solution de l'indicateur coloré a été préparée à partir de la forme acide Hind. L'équation de Hind avec l'eau s'écrit : Hind + H2O = Ind- + H3O+.(1)
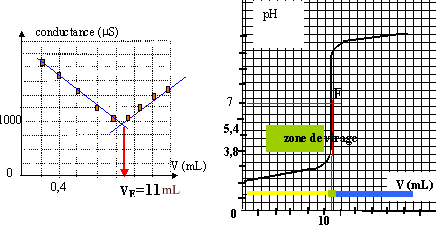
II- dosage d'une solution d'acide chlorhydrique concentré : sur l'étiquette du flacon on lit 33% minimum en masse d'acide chlorhydrique. On veut connaître la concentration molaire c0 de cette solution notée S0. - On dilue 100 fois S0 et on obtient une solution S1 de concentration c1. - On prélève V1=100 mL de S1 que l'on dose par conductimétrie à l'aide d'une solution de'hydroxyde de sodium de concentration cB= 0,1 mol/L. On donne le graphe (a) représentant la conductance de la solution en fonction de lu volume V de la solution titrante versée 
= 2,9 10-5 mol taux d'avancement final t = xfin / xmax = 6,6 10-5*0,1 / 2,9 10-5 = 0,66 / 2,9 = 0,23 le taux d'avancement final est inférieur à 1 : la réaction de l'acide Hind avec l'eau est partielle. à l'équilibre Ka = [H3O+][Ind-] / [Hind]= t c*tc / ((1-t)c) = t 2c/(1-t) Ka = 1,9 10-5 et pka = -log (1,9 10-5) = 4,72. vert de bromocrésol. dosage acide fort base forte H3O+ + HO- --> 2 H2O
A l'équivalence les quantités de matière de soude versée et d'acide sont dans les proportions stoéchiomètriques. C1V1 = CBVE soit : C1 = CBVE / V1 = 0,1*11/100 = 1,1 10-2 mol/L. C0 = 1000 C1 = 11 mol/L m0 = 11*(35,5+1) = 401,5 g d'acide chlorhydrique pur dans un litre, dans 1160 g de solution 401,5 / 1160 = 0,35 ( 35%), en accord avec l'indication. l'indicateur coloré passe du jaune ( acide en excès dans le bécher avant l'équivalence ) au bleu ( soude en excès dans le bécher après l'équivalence). La zône de virage de l'indicateur coloré doit contenir le pH de l'équivalence ( pHéqui = 7 dans ce cas) le bleu de bromothymol est le plus adapté.
|
|||||||||||||||||||||||||||||||||||||||||||||||||
|