|
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
|||||||||||
|
|||||||||||
|
|
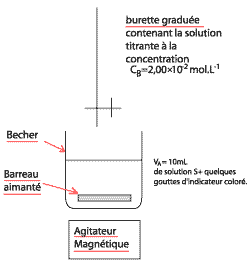
L'acide ascorbique, couramment dénommé vitamine C, est un réducteur naturel que l'on qualifie usuellement d'antioxydant. On le trouve dans de nombreux fruits et légumes. Une carence prolongée en vitamine C favorise le scorbut. On a montré que la vitamine C peut prévenir des petits maux quotidiens tels que le rhume ainsi qu'aider dans le traitement de certains cancers. En pharmacie il est possible de trouver l'acide ascorbique, par exemple sous forme de comprimés "de vitamine C 500". Pour simplifier, l'acide ascorbique, de formule brute C6H8O6, sera désigné par HA dans la suite de l'exercice. Dans cette étude, on envisage la réaction très rapide entre une solution aqueuse d'acide ascorbique de concentration molaire en soluté apporté CA = 1,00 10-2 mol.L-1 et une solution aqueuse d'hydroxyde de sodium de concentration molaire en soluté apporté CB = 2,00 10-2 mol.L-1. Le volume initial de la solution aqueuse d'acide ascorbique est VA = 20,0 mL et on note VB le volume de la solution aqueuse d'hydroxyde de sodium versée.
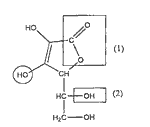 Les propriétés acido-basiques de cette molécule sont dues à l'hydrogène du groupe caractéristique (ou fonctionnel) entouré par un cercle. Cette molécule possède d'autres groupes caractéristiques. A quelle famille de composés correspondent respectivement les groupes caractéristiques (ou fonctionnels) encadrés dans la formule de l'acide ascorbique et notés (1) et (2) ?
Par définition pH = -log([H3O+]f) =4 ; [H3O+]f = 10-4 mol.L-1. Ke = [H3O+]f [HO-]f donc [HO-]f = 10-14 / 10-4 = 10-10 mol/L. n(HO- )f = [HO-]f (VA+VB)= 10-10*25 10-3 = 2,5 10-12 mol pratiquement zéro. Les ions hydroxydes sont totalement consommés donc la réaction est totale. Cette réaction convient pour un dosage car elle est très rapide et totale.
Dosage colorimétrique d'un comprimé de vitamine C : A l'équivalence la solution contient une base A- : le pH est donc supérieur à 7. Le seul indicateur dont la zone de virage contient la valeur 8 est le rouge de crésol, c'est donc lui qu'il faut choisir. Avant l'équivalence, dans le bécher l'acide est en excès. A l'équivalence, il y a changement du réactif limitant (les réactifs ont été introduits dans les proportions stœchiométriques). après l'équivalence la soude est en excès. A l'équivalence : nE(HA) = nE(HO-) nE(HA) = 0,02 * 14,410-3= 2,88 10-4 mol En tenant compte du prélèvement le comprimé contient 10 fois nE(HA) moles d'acide ascorbique. D'où une masse de : m = (12* 6 + 8 + 6* 16) * 10 * 2,88 ´ 10-4= 0,507 g. Cette masse est proche de 500 mg d'où l'indication portée par le fabriquant. Etude de la molécule de HA : (1) est le groupe caractéristique de la famille des esters. (2) est le groupe caractéristique de la famille des alcools.
|
||||||||||
|