|
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
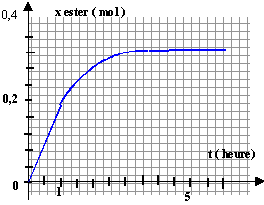
Données : pKa ( CH3COOH/ CH3COO-) = 4,8 ; pKe =14 ; masses atomiques molaires (g/mol) : H=1 ; C=12 ; O=16. masse volumique du propan-1-ol : 0,8 g/mL On étudie la cinétique de formation d'un ester à partir d'acide éthanoïque et de propan-1-ol. On maintient à la température constante, sept erlenmeyer numérotés 1, 2, 3... 7 contenant chacun un mélange de 0,5 mol d'acide éthanoïque et de 0,5 mol de propan-1-ol. Ces tubes sont tous préparés à l'instant t=0 et on dose d'heure en heure l'acide restant dans le mélange ; on peut en déduire la quantité d'ester restant dans le mélange. A t= 1 heure, dosage du tube n°1 ; à t=2 heure, dosage du tube n°2 ,....
éthanoate de propyle. volume d'alcool à utiliser : Qté de matière (mol) = masse (g) / masse molaire alcool 0,5 = m / (3*12+8+16) soit m = 0,5*60=30g. volume (mL) = masse (g) / masse volumique (g/mL) = 30 / 0,8 = 37,5 mL.
titrage : CH3-COOH + HO- --> CH3-COO- + H2O constante de réaction K= [CH3-COO-] / ([CH3-COOH][HO-]) CH3-COOH +H2O = CH3-COO- + H3O+ avec Ka = [CH3-COO-] [H3O+]/ [CH3-COOH] K= [CH3-COO-] [H3O+] / ([CH3-COOH][HO-][H3O+]) = Ka / Ke = 10-4,8 / 10-14 = 109,2 = 1,6 109. K est très grand, la réaction de titrage est totale. Qté de matière d'acide = Qté de matière de soude versée à l'équivalence = 14,2 10-3*1 = 1,42 10-2 mol dans 5 mL 1,42 10-2 *100 /5 = 0,284 mol d'acide restant dans 100mL ( dans l'erlenmeyer) Qté de matière d'ester formé : 0,5-0,284 = 0,216 mol.
xeq = 0,33 mol (lecture graphe à t >5 heures) rendement (ou taux d'avancement final) = xeq /xm = 0,33 / 0,5 = 0,66 (66%). vitesse : v = 1/V dx/dt avec x avancement en mol ; V: volume des réactifs (L); v en mol L-1 s-1. tracer la tangente à la courbe x=f(t) à la date t ; chercher le coefficient directeur de cette tangente pour obtenir dx/dt. la vitesse diminue au cours du temps car les quantités de matière des réactifs diminuent. la tangente à la courbe x=f(t) se rapproche de l'horizontale (
coefficient directeur de plus en plus faible)
K' = [ester]éq[eau]éq/([alcool]éq[acide]éq) [ester]éq =[eau]éq = 0,33 / V ( V volume (L) des réactifs et produits) [alcool]éq=[acide]éq = (0,5-0,33)/V = 0,17/V K' = 0,33²/0,17² = 3,78 K' ne dépend que de la température; à température constante K' est constant.
K' = [ester]éq[eau]éq/([alcool]éq[acide]éq) [eau]éq =[ester]éq = xéq / V ; [acide]éq = (1,5-xéq)/V ; [alcool]éq=(0,5-xéq)/V K' = x²éq / ((1,5-xéq)(0,5-xéq)) = 3,78 x²éq = 3,78(1,5-xéq)(0,5-xéq) x²éq = 3,78(x²éq -2xéq+0,75) 0,264 x²éq = x²éq -2xéq+ 0,75 x²éq -2,72 xéq + 1,02 = 0 xéq = 0,45 mol (l'autre solution étant supérieure à xm ne peut pas être retenue) rendement (ou taux d'avancement final) = xeq /xm = 0,45 / 0,5 = 0,90 (90%). l'équilibre est déplacé dans le sens direct, formation de l'ester.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|