|
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
|||||||||||||||||||||||
|
|||||||||||||||||||||||
|
|
L'acide oléique, présent dans certaines huiles, est un acide gras insaturé. Les acides gras insaturés sont des acides carboxyliques contenant plus de 10 atomes de carbone et une ou plusieurs doubles liaisons carbone-carbone. Leur formule brute est de la forme CnH2n+1-2dCOOH où d est le nombre de doubles liaisons. Principe 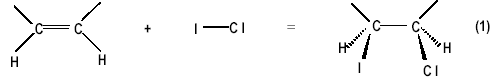 Le chlorure d'iode ICl est introduit en excès ; le titrage de cet excès permet ensuite la détermination du nombre de doubles liaisons d dans la molécule. Masse molaire de l.acide oléique : 282 g.mol-1. Détermination de la formule brute d.un acide gras - Bac S, physique-chimie - 1/4 Protocole opératoire Étape 1 : Action du chlorure d'iode *Dans un erlenmeyer, on introduit : • vICl = 10,0 mL d'une solution de chlorure d'iode de concentration CICl = 0,11 mol.L-1 ;• 250 mL de cyclohexane ; • m2 = 0,20 g d.acide oléique. *On bouche et on agite. *On place à l'obscurité pendant 45 minutes en agitant de temps en temps. La transformation qui a lieu dans cette étape est modélisée par la réaction d'équation (1). Étape 2 : Transformation de ICl en excès en diiode L'excès de chlorure d'iode ne pouvant être dosé facilement, il est transformé intégralement en diiode selon la réaction d'équation : ICl + I- = I2 + Cl- (2) *On ajoute dans l'erlenmeyer : • 20,0 mL d.une solution d.iodure de potassium ;• 100 mL d.eau distillée. *On agite et on attend quelques minutes dans l'obscurité. Étape 3 : Titrage du diiode *Le diiode formé au cours de la deuxième étape est titré par une solution de thiosulfate de sodium de concentration molaire C0 = 0,10 mol.L-1 en présence d'empois d'amidon selon la réaction d'équation : I2 + 2 S2O32- = S4O62- + 2 I- (3) On a versé à l.équivalence un volume de solution de thiosulfate de sodium VE = 7,6 mL. Questions
Une pipette jaugée pour prélever les 10,0 mL de chlorure d.iode car on a besoin de connaître précisément la quantité introduite. Une éprouvette graduée.
D'après l'équation (2) n= n(I2) = n(ICl)excès = 3,8×10-4 mol n(ICl)0 = CICl × VICl = 0,11 × 10,0×10-3 = 1,1×10-3 mol. n(ICl)0 = n(ICl)f + n(ICl)excès D'où n(ICl)f = n(ICl)0 - n(ICl)excès = 1,1×10-3 - 3,8×10-4 = 7,2×10-4 mol Détermination de la formule brute de l'acide oléique nacide oléique = m / masse molaire acide oléique = 0,2/282 = 7,1 10-4 mol D'après l'équation (1), une molécule de ICl s'additionne sur une double liaison. Or nacide oléique voisin n(ICl)f donc chaque molécule comporte une double liaison. La formule brute de l.acide oléique est de la forme CnH2n-1COOH car c'est un acide gras insaturé comportant une double liaison. D'où 12n + (2n-1)×1 + 12 + 2×16 +1 = 282 14n + 44 = 282 n = 17 La formule brute est C17H33COOH.
|
||||||||||||||||||||||
|