|
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
|||||||||||||||||||||||
|
|||||||||||||||||||||||
|
|
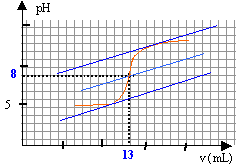
On se propose de doser par pH-mètrie un vinaigre afin d'en déterminer la concentration molaire volumique en acide éthanoïque. Pour cela, on prépare V = 100 mL d.une solution diluée 10 fois du vinaigre. Puis on prélève un volume V1 = 10 mL de la solution diluée que l'on verse dans un bécher, auquel on ajoute suffisamment d'eau distillée pour immerger correctement la cellule du pH-mètre. On réalise le dosage avec une solution d'hydroxyde de sodium de concentration molaire volumique c2 = 0,1 mol.L-1. Le pH est relevé en fonction du volume V2 de solution d'hydroxyde de sodium et on obtient la courbe pH = f(V2). 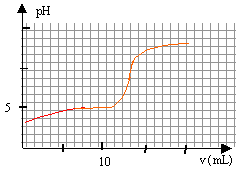 Toutes les solutions considérées sont prises à 25°C. Donnée : pKa du couple CH3COOH / CH3COO- à 25 °C= 4,8 et pKe = 14.
Qr= [CH3-COO-] / ([CH3COOH ][HO-]) Qr= [CH3-COO-] [H3O+] / ([CH3COOH ][HO-][H3O+]) Qr,éq=10-4,8 / 10-14 = 109,2 = 1,6 109. Le quotient de réaction dans l'état d'équilibre d'un système Qr,éq prend une valeur indépendante de la composition initiale, qui est la constante d'équilibre associée à l'équation de la réaction. Les réaction acide base sont rapides, l'équilibre est très vite atteint. La valeur précédente Qr,éq est grande, la transformation est totale et peut servir de support à la réaction du dosage.
à l'équivalence les quantités de matière d'acide et de base sont stoéchiométriques. Avant l'équivalence l'acide est en excés, après l'équivalence la base est en excès. A l'équivalence les espèces majoritaires sont: l'ion éthanoate, l'ion sodium apporté par la soude, les molécules d'eau. la solution contient une base faible, l'ion éthanoate majoritaire, le pH de la solution est donc supérieur à 7. n1 = V1C1 = 0,01 C1. n2,éq = V2,éq C2 = 0,013*0,1 = 1,3 10-3 mol 1,3 10-3 = 0,01 C1 d'où C1 = 1,3 10-3 / 0,01 = 0,13 mol/L le vinaigre est dix fois plus concentré : 1,3 mol/L.
= 6,5 10-4
mol = 6,5 10-4
mol le pH à la demi équivalence est égal au pKa du couple acide base acide éthanoïque / ion éthanoate. Les quantités de matière d'acide éthanoïque et d'ion éthanoate sont identiques, donc pH=pKa=4,8. La valeur lue sur la courbe est 5, valeur très proche de 4,8 ( écart de l'ordre de 4%)
|
||||||||||||||||||||||
|