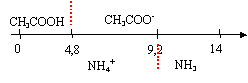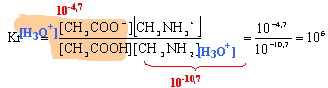|
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
|||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||
|
|
Données :
AH = A- + H+. la mesure du pH permet de trouver l'avancement final : pH=3,4 donc [H3O+] = 10-3,4 = 4 10-4 mol/L. alors xfin = 4 10-4 V ; V volume de la solution en litre. la concentration en acide conduit à l'avancement maximal : xmax = cV = 0,01V mol le taux d'avancement final vaut : t = xfin / xmax = 4 10-4 /0,01 = 0,04 valeur très inférieur à1, donc l'acide éthanoïque est un acide faible. H3C-COOH + H2O= H3C-COO-+H3O+. Ka = [H3C-COO-][H3O+] /
[H3C-COOH]
à pH = 5 , l'ion
ammonium et l'ion éthanoate prédominent.
=3 10-4 la constante Kr est grande : la réaction est totale. le mélange final contient l'acide CH3NH3+ et sa base conjuguée CH3NH2 . ce couple acide base impose le pH final. pH= pKa + log([CH3NH2] / [CH3NH3+]) pH= 10,7 + log (2 10-4 / 10-4 )=10,7 + log 2 = 11.
|
||||||||||||||||||||||||||||||
|