|
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
||||||
|
||||||
|
|
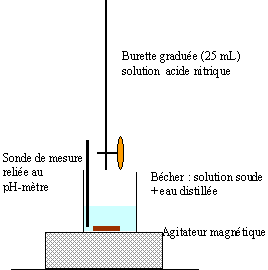
Deux élèves de terminale, Antoine et Sophie disposent d'une solution commerciale d'un produit caustique, une solution d'hydroxyde de sodium portant les indications suivantes : densité d=1,03 ; pourcentage massique en hydroxtde de sodium ; 15 %. Ils se proposent de doser cette solution en réalisant un suivi pHmétrique de la réaction entre l'acide fort (l'acide nitrique HNO3) et cette solution. Il reste à leur charge l'élaboration d'un protocole expérimental. Pour les questions 3 à 7 on prendra la valeur C0 = 4 mol/L
et contient en masse 1030*15/100= 154,5 g de soude pure masse molaire hydroxyde de sodium (soude) NaOH= 40 g/mol Qté de matière de soude : 154,5 / 40 = 3,86 mol dans 1 L. dosage acide fort base forte : H3O+ + HO---> 2H2O. Manipuler des solutions concentrées corrosives ou caustiques nécessite des précautions : port de gants, blouse et lunettes de protection ; en conséquence il vaut mieux travailler sur des solutions diluées. facteur de dilution : 50 donc Cb = 4/50 = 0,08 mol/L.
A l'équivalence du dosage les quantités (mol) d'acide ajouté et de soude sont dans les proportions stoéchiométriques CaV1 = Cb Vb soit V1 = 0,08*10/0,8 = 1 mL ce volume ajouté à la burette n'est pas déterminé de manière suffisamment précise. ( erreur environ 10% soit une demi division de la burette graduée). facteur de dilution : 200 / 15 = 13,33 Ca = 0,8 / 13,33 = 0,06 mol/L volume d'acide à l'équivalence Véq =0,08*10/0,06 = 13,3 mL. facteur de dilution : 500 / 15 = 33,33 C'a = 0,8 / 33,33 = 0,024 mol/L volume d'acide à lé'quivalence V'éq =0,08*10/0,024 = 33,3 mL. dans ce cas on dépasse le volume total de la burette qui est 25 mL : cette dilution n'est pas à retenir. L'ajout d'eau distillée permet à la sonde du pHmètre d'être correctement immergée : l'eau distillée n'apporte quasiment pas d'ion HO- ou H3O+ et en conséquence ne modifie pas le volume d'acide ajouté à l'équivalence. A l'équivalence d'un dosage acide fort base forte, le pH est égal à 7.
|
|||||
|