|
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
||||||
|
||||||
|
|
On donne les potentiels standart d'oxydoréduction E(I2/I-) = 0,62 V et E(Zn2+/Zn) = -0,76 V. On vend en pharmacie sous le nom de Lugot un antiseptique à base de diiode. Les solutions de diiode sont brunes. On plonge dans le Lugot une plaque de zinc.
Le zinc est un réducteur plus fort que le diiode : le zinc s'oxyde Zn--> Zn2+ + 2e-. Le diiode est l'oxydant, il se réduit I2 + 2e- --> 2I-. le diiode est un
réactif, sa concentration diminue au cours de la réaction : la
coloration brune du diiode s'atténue au cours du temps : les autres
espèces en solution sont incolores.
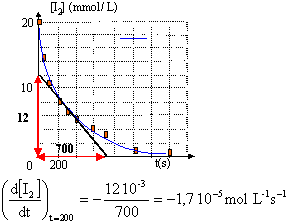
V : volume constant de la solution et nI2 : quantité de matière de diiode à l'instant t. On trace la tangente à la courbe à la date t= 200 s et on détermine son coefficient directeur.
v = 1,7 10-5 mol L-1 s-1.
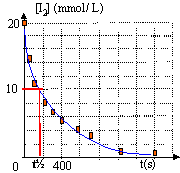
La réaction étudiée est totale : le diiode est supposé être le réactif limitant. Le temps de demi- réaction est la durée au bout de laquelle la concentration en diiode est égale à la moitié de sa valeur initiale.
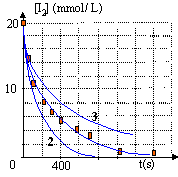
t½ voisin de 160 s. La température est un facteur cinétique : si la température augmente, la vitesse de disparition du diiode augmente (courbe 2) La concentration en diiode est un facteur cinétique : la concentration [I2] diminue en solution diluée et en conséquence la vitesse de disparition du diiode diminue ( courbe 3). le facteur de dilution est de : 100 / 50 = 2 la concentration de la solution diluée est : 0,02 / 2 = 0,01 mol/L.
|
|||||
|