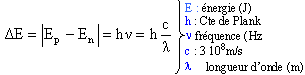|
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
|||||||||||||
|
|||||||||||||
|
|
Données : célérité de la lumière dans le vide :3 108 m/s; constante de Plank : h=6,62 10-34 Js ; charge élémentaire : e = 1,6 10-19 C ; masse de l'électron m = 9 10-31 kg. La figure ci dessous représente un diagramme très simplifié des niveaux d'énergie de l'atome de lithium de numéro atomique Z=3, de formule électronique K2L1. 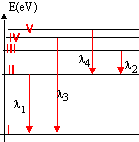 On considère les quatre transitions représentées sur le diagramme. Les longueurs d'ondes correspondantes sont l1 = 671 nm ; l2 = 812 nm ; l3 = 323 nm et l4 = 610 nm.
Une transition atomique est le passage d'un état d'énergie à un autre. La fréquence d'un photon émis ou absorbé est reliée aux énergies En et Ep par la relation de Bohr :
Chaque raie d'un
spectre est associée à l'émission ou l'absoption d'un photon lors d'une
transition atomique.
W : diviser par 1,6 10-19 pour passer des joules aux électrons volts l : multiplier par 109 pour passer des mètres aux nanomètres. W l ( en eV nm) = 1,986 10-25 *109 / 1,6 10-19 = 1241.
1,523 eV : différence d'énergie entre le niveau excité n=3 et l'état excité n=2 donc E3 = -3,54+ 1,523 = -2,02 eV 3,84 eV : différence d'énergie entre le niveau fondamental et l'état excité n=4 donc E4 = -5,39 + 3,84 = -1,55 eV 2,03 eV : différence d'énergie entre le niveau excité n=5 et l'état excité n=2 donc E5 = -3,54+ 2,03 = -1,51 eV à partir de l'état fondamental, il faut fournir une énergie minimale de 5,39 eV pour ioniser l'atome. E= 5,36 eV = 5,39*1,6 10-19 = 8,624 10-19 J E = hc / l soit l = hc/E = 6,62 10-34*3 108 /8,624 10-19= 2,3 10-7 m. |
||||||||||||
|