|
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
|||||||||||||||||||
|
|||||||||||||||||||
|
|
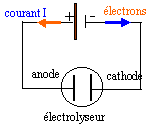
On produit industriellement le cadmium par électrolyse d'une solution de sulfate de cadmium ( Cd2+ et SO42-) et d'acide sulfurique. L'électrolyse est réalisée sous une tension de 3,1 V et le générateur délivre un courant I=25 kA. Les ions sulfates ne participent pas aux transformations.
masse atomique molaire en g/mol : Cd = 112,4 et Ag = 108 ; 1F = 96500 C. couples oxydoréducteurs : Cd2+ / Cd ; H+ / H2(g) ; O2(g) / H2O(l).
les ions sulfates SO42-, cadmium Cd2+, H3O+ oxonium, les molécules d'eau sont présents. Le cadmium métal se dépose à la cathode négative, électrode sur laquelle les ions Cd2+ sont réduits Cd2+ + 2e- = Cd(s) à l'anode positive les molécules d'eau sont oxydées en dioxygène : H2O = ½O2 + 2H+ + 2e- équation de la transformation : Cd2+ + H2O = Cd(s) + ½O2 + 2H+ . en solution les ions positifs Cd2+, H3O+ se déplacent vers l'électrode négative, la cathode où ils peuvent éventuellement se réduire. Les ions négatifs SO42-, se déplacent vers l'anode positive. Quantité d'électricité :
I = 25 kA = 2,5 104 A ; t= 12*3600 = 43 200 s Q =2,5 104 *43 200 =1,08 109
C.
masse de cadmium : qté de matière (mol) * masse molaire (g/mol) =5,6103 *112,4 = 629 kg. en réalité la masse est inférieure car une autre réaction est possible à la cathode : les ions H+ sont susceptibles de se réduire en H2 à la cathode : 2H+ + 2e- = H2(g). énergie (J) = qté d'électricité (C) fois tension (V) E = 1,08 109 * 3,1 = 3,35 109 J pour 580 kg de cadmium soit 5,77 106 J par kg et 5,77 109 J par tonne. |
||||||||||||||||||
|