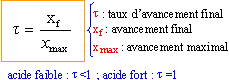|
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
|||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||
|
|
Les mesures sont effectuées à 25°C. couples acide base : : acide éthanoïque / ion éthanoate pKa = 4,7 ; ion ammonium / ammoniac pKa = 9,2
recherche de l'avancement maximal :
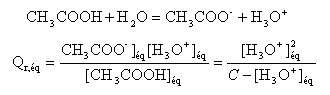
On note [ H3O+]éq = xf = x et on remarque que Qr,éq= Ka = 10-4,7 = 2 10-5. x² = 2 10-5 (0,02-x) = 4 10-7 -2 10-5 x x² +2 10-5 x - 4 10-7 =0 résoudre cett équation D= 4 10-10 +16 10-7 = 1,6 10-6 x = ½(-2 10-5 +1,26 10-3) = 6,3 10-4. ; l'autre solution négative ne convient pas. l'avancement final est très inférieur à l'avancement maximal ; le taux d'avancement est :
t = 1,6 10-4 / 0,02 = 0,03 (3%) : l'acide éthanoïque est un acide faible. la mesure du pH confirme ce résultat : [ H3O+]éq = 10 -3,2 = 6,3 10-4. NH3 + H2O = HO - + NH4+ recherche de l'avancement maximal :
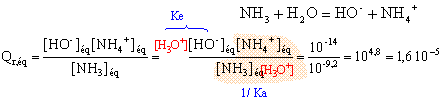
On note [ NH4+]éq = xf = x et on remarque que [ NH3]éq = 0,01-x x² = 1,6 10-5 (0,01-x) = 1,6 10-7 -1,6 10-5 x x² +1,6 10-5 x - 1,6 10-7 =0 résoudre cett équation D= 2,56 10-10 +6,4 10-7 = 6,4 10-7 x = ½(-1,6 10-5 +8 10-4) = 3,92 10-4 ; l'autre solution négative ne convient pas. l'avancement final est très inférieur à l'avancement maximal ; le taux d'avancement est :
t = 3,92 10-4 / 0,01 = 0,04 (4%) : l'ammoniac est une base faible. la mesure du pH confirme ce résultat : [ H3O+]éq = 10 -10,6 = 2,5 10-11. [HO-]éq = 10-14 / 2,5 10-11 = 4 10-4 mol/L 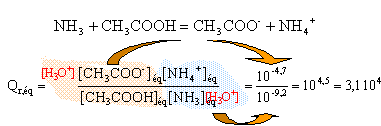
La constante d'équilibre étant supérieure à 104, cette transformation peut être considérée comme totale.
|
||||||||||||||||||||||||||||||||||||||||||
|