|
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
On mesure la conductivité de différentes solutions d'acide éthanoïque :
On fait l'hypothèse que les solutions ont un volume égal à 1L ; on désigne par C la concentration d'une solution d'acide éthanoïque.
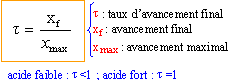
on calcul l'avancement final xf à partir de la conductivité de la solution : les ions oxonium et éthanoate contribuent à la conductivité de la solution : s = (l H3O+ +l éthanoate ) [H3O+]= ( 3,5 +0,41) 10-2 [H3O+] soit [H3O+] = s /3,91 10-2 = 25,56 s . [H3O+] s'exprime en mol m-3 ; xf = [H3O+] 10-3 = 25,56 10-3 s mol.
le taux d'avancement final augmente lorsque la concentration en acide éthanoïque ( acétique) diminue. règle de Le Chatelier ou règle de modération: en ajoutant de l'eau (un réactif) on déplace l'équilibre dans le sens "comsommation de l'eau", c'est à dire dissociation de l'acide faible en ion oxonium et éthanoate. par dilution, un acide faible se rapproche du comportement d'un acide fort.(t tend vers 1). |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|