|
Nlle Calédonie 11/ 01 (sans calculatrice) En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
||||||
|
||||||
|
|
L'acide borique est un antiseptique léger, peu irritant, utilisé par exemple en solution aqueuse diluée dans le " lave-oeil " que l'on trouve dans les laboratoires de chimie. L'acide borique sera considéré comme un monoacide faible. Son dosage direct par l'hydroxyde de sodium ou soude est délicat en pH-métrie ou avec un indicateur coloré. Par contre, en présence d'un excès de polyol, le comportement de l'acide borique en solution aqueuse est modifié. On représente par HA la molécule constituée à partir de l'acide borique et du polyol. L'acide HA est un monoacide faible. Données : pKa1(H3O+/H2O) = 0,0 ; pKa2(H2O/HO-) = 14,0 ; pKa3(H3BO3/H2BO3-) = 9,2 ; pKa4(HA/A-) = 6,5. Tous les résultats numériques seront exprimés sous la forme 10n (n étant un nombre réel). Etude de l'acide borique et de l'acide HA :
Etude comparative des dosages :
Kr1 = [H2BO3-][H3O+] / [H3BO3] = Ka2 = 10-9,2. cette constante est très inférieure à 1 : la réaction ci-dessus est donc très limitée : l'acide borique est un acide faible. A concentration
égale, l'acide le plus fort possède le plus grand pKa : l'acide HA (
pKa = 6,5)est donc plus fort que l'acide borique. (pKa = 9,2)
Kr2 = [H2BO3-] /( [H3BO3] [HO-])= [H2BO3-][H3O+] /( [H3BO3] [H3O+] [HO-]) Ka2 = 10-9,2 / 10-14 = 10 4,8. cette constante
est très grande : la réaction ci-dessus est donc totale.
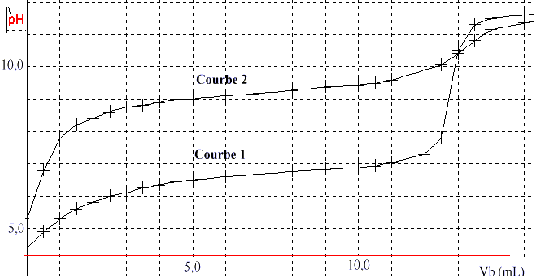
à concentration égale, l'acide le plus fort possède le pH le plus élevé. courbe 1, le pH initial est de 4,5 ( acide HA) courbe 2, le pH initial est de 5,5 ( acide borique) à la demi-équivalence du dosage acide faible - base forte le pH est égal au pKa . courbe 1 , pH= 6,5 pour Vb = ½V équi ( acide HA) courbe 2 , pH= 9,2 pour Vb = ½V équi ( acide borique) le pH de l'équivalence doit se trouver dans la zone de virage de l'indicateur coloré courbe 1 : pH équi = 9 , valeur situé dans la zone de virage de la phénolphtaléine courbe 2 :pH équi = 10,5 , valeur situé en dehors de la zone de virage de la phénolphtaléine. par contre en présence du polyol , la molécule d'acide borique se comporte comme l'acide HA : son dosage par la méthode précédente devient alors possible. |
|||||
| |
||||||
|