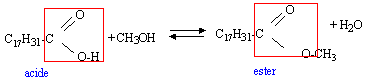|
Nlle Calédonie 11/ 01 (sans calculatrice) En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
|||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||
|
|
Dès 1987, la France a autorisé la fabrication de biocarburants (carburants d'origine agricole), destinés à être incorporés aux carburants et au fioul domestique. Parmi eux, on trouve les esters méthyliques d'huiles végétales (E.M.H.V.) synthétisés à partir d'huile de colza ou d'huile de tournesol et de méthanol. (Aucune connaissance théorique n'est nécessaire à propose de cette réaction.) Pour synthétiser l'ester de colza ou EMC, un laboratoire de recherche propose le protocole ci-dessous. Réactifs : Les réactifs mis en jeu sont l'huile de colza, considérée comme constituée exclusivement de trilinoléate de glycéryle, et le méthanol anhydre. La réaction est catalysée. Huile de colza : m1 = 100 g ; méthanol : m2 = 25 g ; Opérations :
données :
Préliminaires et approche théorique :
étude du protocole :
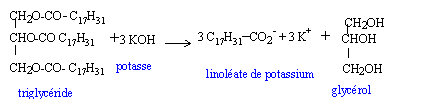
1 mol de trilinoléate de glycéryle + 3 mol de méthanol --> 3 mol d'EMC + 1 mol de glycérol Qté de matière d'huile de colza : 100 / 878 mol Qté de matière de méthanol : 3 * 100 / 878 mol ( environ 1/3) masse de méthanol
: 300 / 878 * 32 g ( environ 32/3 = 10g)
On peut espérer obtenir 3 * 100 / 878 mol d'EMC ( environ 1/3 mol) masse d'EMC : 300 / 878 * 294 g (environ 100g) Quand la réaction est terminée, il reste du méthanol ( environ 15 g), il s'est formé de l'EMC et du glycérol; l'huile de colza a été entièrement consommée. Le glycérol et l'ester (EMC) sont deux liquides non miscibles De plus leurs densités sont très différentes ( 0,89 pour l'ester et 1,25 pour le glycérol) On peut les séparer par décantation : le liquide le plus dense ( glycérol) se trouve dans la partie inférieure de l'ampoule à décanter. le méthanol , miscible à l'ester et de densité voisine ne peut pas être séparé de l'EMC par décantation. Par contre ces deux liquides ont des températures d'ébullition
nettement différentes : une séparation sera possible par distillation.
Le méthanol distille et l'EMC restera dans le ballon.
masse d'EMC =( volume (cm3) fois masse volumique (g/cm3) = 80 * 0,89 g ( environ 72 g) rendement = 72 / 100 = 0,72 ou 72%.
|
||||||||||||||||||||||||||||||||||
| |
|||||||||||||||||||||||||||||||||||
|