|
Inde 04/00 En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
|||||||||||||||||||||
|
|||||||||||||||||||||
|
|
La vitamine C ou acide ascorbique ( noté AH par la suite) est vendue en pharmacie sous forme de comprimé à croquer. masse molaire acide ascorbique : 176 g/mol ; pKa acide ascorbique = 4,05 ; masse d'acide ascorbique contenue dans un comprimé = 500 mg ; concentration de la solution de soude = Cb=0,02 mol/L.
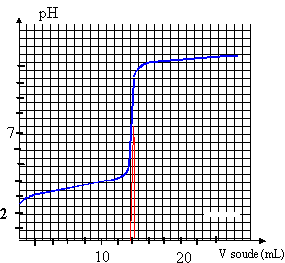
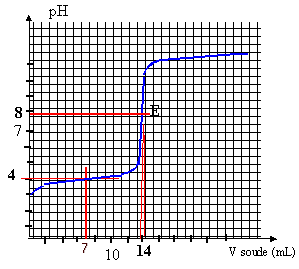
On prélève un volume Va = 10 mL de S, on le verse dans un bécher et on y ajoute un volume d'eau distillée de 20 mL environ. Le dosage pHmètrique assisté par ordinateur de cet échantillon par une solution d'hydroxyde de sodium (ou soude) donne les graphes ci dessous :
la constante de la réaction étant grande, la réaction est totale, quantitative et peut servir de support à un dosage. à l'équivalence : pH voisin de 8 et V équi = 14 mL (lecture graphe) à l'équivalence acide base les quantités de matière des réactifs mises en présence sont dans des proportions stoéchiométriques. Avant l'équivalence l' acide est en excès; après l'équivalence la soude est en excès CaVa = Cb Véqui Ca = 14 *0,02 / 10 = 0,028 mol/L. soit 0,28 mmol dans 10 mL ou 2,8 mmol dans 100 mL de la solution S ( dissolution d'un comprimé) masse de vitamine C dans un comprimé : 2,8 * 176 = 493 mg. en accord avec l'indication 500 mg.
le pH à la demi équivalence est égal au pka du couple acide base: lecture graphe pKa voisin de 4 un indicateur coloré permet de repèrer l'équivalence du dosage acide base. la zone de virage de l'indicateur doit contenir le pH à l'équivalence, pH=8 dans ce cas. on choisit le rouge de crésol. |
||||||||||||||||||||
|
|
|||||||||||||||||||||
|