|
Antilles 09/00 En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
On mélange 1,5 L d'une solution d'éthanoate d'éthyle de formule CH3-COO-C2H5 de concentration molaire C1 = 0,02 mol/L avec 1,5 L d'une solution d'hydroxyde de sodium de concentration C2 = 0,02 mol/L.
CH3-COO-C2H5 + Na+ + HO- ---> CH3-CO2- + Na+ + C2H5OH les produits sont l'alcool éthylique (ou éthanol ) et l'éthanoate de sodium.
cet ion hydroxyde possède un excès d'électrons ; il peut réagir facilement avec le carbone du groupe ester ( carbone possédant un défaut d'électrons). Cet ion hydroxyde constitue un site nucléophile. le carbone du groupe ester constitue un site électrophile. la saponification résulte de l'interaction entre ces deux sites. concentration de l'alcool : la quantité de matière d'ion hydroxyde initiale est : 1,5 * 0,02 = 0,03 mol volume total du mélange : 3L donc [HO-]0=0,03 / 3 = 0,01 mol/L.
avec x = Qté de matière initiale d'hydroxyde de sodium - Qté de matière restante d'hydroxyde de sodium à la date t x = 0,03 - 3*[HO-]t et [alcool]t = x /3 = 0,01 -[HO-]t mol/L= 10 -[HO-]t mmol/L
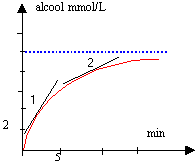
la vitesse instantanée de formation de l'alcool est égale au coefficient directeur de la tangente à la courbe ci dessus à la date considérée. en (1) le coefficient directeur de la tangente est bien supérieur au coefficient directeur en (2). la vitesse instantanée de formation de l'alcool diminue au cours du temps. la concentration des réactifs diminue au cours su temps et cette concentration est un facteur cinétique : la vitesse de formation de l'alcool est d'autant plus petite que la concentration des réactifs est plus faible. saponification : La saponification des triglycérides (triester du glycérol) par la soude ou la potasse conduit à la formation de savon ( carboxylate de sodium ou de potassium) et à la formation de glycérol (propane-1,2,3-triol) HO-CH2-CHOH-CH2OH. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|