|
Antilles 06/97. En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||
|
|
C'est une réaction de dismutation lente à température ambiante, catalysée par l'ion Fe3+. Le peroxyde d'hydrogéne se comportant comme un réducteur peut être oxydé par l'ion permanganate MnO4- suivant l'équation bilan : Cette réaction est rapide à 25°C. étude expérimentale : Dans un erlenmeyer de 250 mL on verse 5 mL d'une solution acidifiée de chlorure ferrique puis 85 mL d'eau. A l'instant origine on ajoute 10 mL d'eau oxygénée du commerce. Toutes les cinq minutes on prélève 10 mL du mélange précédent auquel on ajoute 40 mL d'eau glacée et 10 mL d'une solution d'acide sulfurique de concentration 1 mol/L. On dose chaque prise d'essai par une solution de permanganate de potassium de concentration 0,02 mol/L. Le volume de permanganate de potassium nécessaire pour obtenir une coloration persistante sera noté V1. Les prélevements éffectués ne modifient pas la cinétique de la réaction étudiée.
|
|||||||||||||||||||||||||||||||||||||||||||||||
|
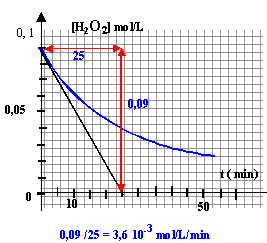
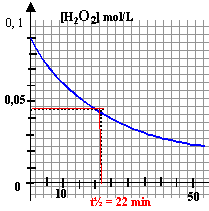
l'ajout d'eau glacée réalise un blocage cinétique de la réaction de dismutation de H2O2 . la composition de la solution ne varie plus : le dosage de H2O2 restant est alors possible. d'après l'équation bilan du dosage par les ions permanganate: A l'équivalence
[ H2O2 ] = 2,5 [MnO4-
] V1 / V2
la solution commerciale d'eau oxygénée a éte diluée 10 fois : 10 mL H2O2 dans 85 +5 +10 = 100 mL [ H2O2 ] = 2,5 *0,02 / 10 V1= 5 10-3 V1. il s'agit de la concentration de l'eau oxygénée dans l'erlenmeyer
la réaction de dismutation lente est remplacée par deux réactions rapides où intervient Fe3+.
|
||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||