|
Antilles 09/96. En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||
|
|
On étudie la cinétique de l'oxydation des ions iodures par les ions peroxodisulfates dont l'équation bilan est la suivante : On réalise 5 expériences; les
conditions expérimentales sont décrites dans le tableau ci dessous . On
note [I-]0 et [ S2O82-
]0 les concentrations initiales à t=0.
|
||||||||||||||||||||||||||||||||
|
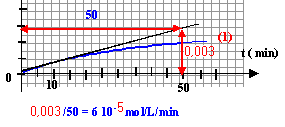
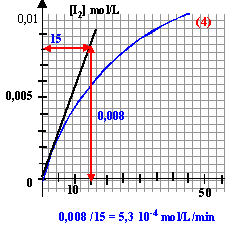
variation de la concentration du diiode (mol/L) divisée par la durée de cette variation en min vf(I2) = d[I2] / dt sur les graphes il suffit de tracer la tangente à la date considérée et de déterminer le coefficient directeur de cette droite
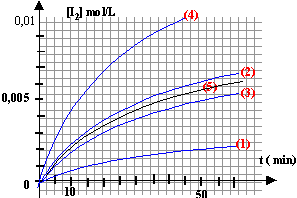
la vitesse de formation du diiode augmente avec la concentration des réactifs. courbes 1 et 3 ou 2 et 4 : seule la température augmente la vitesse de formation du diiode augmente avec la température. courbes 1 et 5 : concentrations des réactifs et température identiques catalyseur (courbe 5) et pas de catalyseur (courbe 1) la vitesse de formation du diiode augmente avec la présence d'un catalyseur.
|
|||||||||||||||||||||||||||||||||
|