|
bac centre étranger 06 /99. En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||
|
|
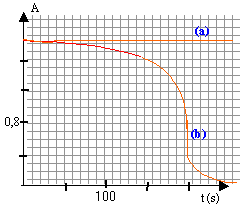
L'énergie lumineuse absorbée par une espèce colorée dépend de la longueur d'onde utilisée. Un aspectrophotomètre, une fois réglé, donne une mesure de cette absorption par l'intermédiaire d'une grandeur numérique sans dimension: l'absorbance A. En général l'absorbance est proportionnelle à la concentration molaire de l'absorbant. A=k C. Un technicien veut suivre par spectrophotométrie la réaction en milieu acide entre les ions MnO4- (qui donnent à la solution une couleur violette) et les molécules incolores d'acide oxalique H2C2O4. 1ère étape : Il place dans le spectrophotomètre une cuve contenant 1 mL de permanganate de potassium à 2 10-3 mol/L; 0,5 mL d'acide sulfurique à 0,5 mol/L et 1 mL d'eau. Cette cuve est traversée par un faisceau lumineux adéquat. L'appareil délivre la courbe (a) ci dessous.
2 ème étape : Il remplace la cuve par une autre contenant 1 mL de permanganate de potassium à 2 10-3 mol/L; 0,5 mL d'acide sulfurique à 0,5 mol/L et ajoute 1 mL de solution d'acide oxalique à 5 10-3 mol/L à la date t=0. L'appareil trace alors la courbe (b) représentative de l'évolution de la réaction totale d'équation bilan : 2 MnO4- + 5 C2H2O4 + 6H3O+ --> 2Mn2+ + 10CO2 + 14H2O
|
||||||||||||||||||||||||||||||
|
l'absorbance est constante et en conséquence la concentration de l'ion permanganate est constante au cours du temps. A =1,75 = k C avec C (mol/L) = qté de matière MnO4- (mol) / volume de la cuve (L) C= 2 10-3 * 10-3 / (2,5 10-3 )= 8 10-4 mol/L k= 1,75 / 8 10-4 = 2,18 103 L mol-1.
l'ion permanganate, la seule espèce colorée, est concerné par la mesure. l'absorbance diminue et en conséquence la concentration de l'ion permanganate diminue au cours du temps. vitesse de disparition d'un réactif (mol L-1min-1)= v = - d[MnO4-]/dt = -dC/dt X= 100 (-d(kC)/ dt = 100 k (-dC/dt) = 100kv.
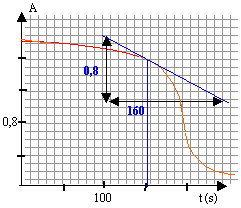
coefficient directeur de la tangente = dA/dt = -0,8 /160 = -5 10-3 s-1 ou bien -5 10-3 *60 = -0,3 min-1. X= -100*(-0,3) = 30 min-1. v = X / (100k) =30 / (100*2,18 103) = 1,37 10-4 mol/L/min. la vitesse croît , passe par une valeur maximale vers t=230s, puis décroit rapidement ensuite. Un catalyseur augmente la vitesse d'une réaction; il n'apparaît pas dans le bilan. Dans certains cas il peut orienter une réaction si deux issues sont possibles. dans le cas présent , la vitesse est faible au départ, la concentration du catalyseur étant faible. puis la vitesse augmente, car la concentration du catalyseur (l'un des produits de la réaction) augmente. Un autre facteur intervient : la concentration du réactif , ion permanganate. vers la fin, la concentration de ce réactif est de plus en plus faible; ce facteur l'emporte sur la concentration importante du catalyseur et en conséquence la vitesse diminue rapidement.
|
|||||||||||||||||||||||||||||||
|