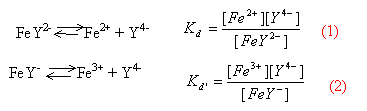|
précipitation et complexation ; élément carbone bac 09 / 00
|
||||||||||||||
|
|
précipitation et complexation : Les trois questions sont indépendantes.
Données (à 25 °C): Constantes d'acidité des couples acide/base: pKa (CH3COOH/CH3COO-) = 4,8. pKa (HCOOH/HCOO-) = 3,8. Produit ionique de l'eau: Ke = 1,0 10-14 Produits de solubilité : Fe(OH)2 : KS = 1,0 10-15. Fe(OH)3 : KS' = 1,0 10-38. Constantes de dissociation des complexes: FeY2- : Kd = 5 10-15. FeY- : Kd' = 6 10-25. Potentiel standard : E° (Fe3+/Fe2+) = 0,77 V. On prendra (RTln x)/F = 0,06 lg x (en volt)
autour de l'élément carbone: L'élément carbone existe sous forme de trois nucléides:
Données: 1 u.m.a. = 1,66056 10-27 kg masse du proton : 1,00727 u.m.a. masse du neutron : 1,00866 u.m.a. célérité de la lumière dans le vide : c = 3,0 108 m.s-1 1 MeV = 1,6 10-13 J Numéros atomiques (Z) de quelques éléments:
|
|||||||||||||
|
Une solution tampon est constituée à partir d'un acide faible et de sa base cojuguée. Il faut donc ajouter du méthanoate de sodium, l'ion méthanoate est la base conjuguée de l'acide méthanoïque. pH=pKa+ log [HCOO-] / [HCOOH] log [HCOO-] / [HCOOH] = 3,2 -3,8 = -0,6 [HCOO-] / [HCOOH] = 0,25 [HCOO-] = 0,25 * 8 10-2 = 0,02 mol/L soit 2 10-3 mol de méthanoate de sodium dans 100 mL
Fe(OH)2 en équilibre avec Fe2+ + 2HO- [Fe2+] =10-3 mol/L pH=3,2 : [HO-]=10-14 / 10 -3,2 =1,6 10-11 mol/L [Fe2+][HO-]2= 10-3 * (1,6 10-11)² = 2,56 10-25 la valeur 10-15 n'étant pas atteinte, il n'y a pas apparition du précipité. [Fe2+] = 10-3 mol/L Fe(OH)3 en équilibre avec Fe3+ + 3HO- [Fe3+] =10-3 mol/L pH=3,2 : [HO-]=10-14 / 10 -3,2 =1,6 10-11 mol/L [Fe3+][HO-]3= 10-3 * (1,6 10-11)3 = 4,096 10-36 cette valeur est supérieure à 10-38, il n'y a pas apparition du précipité Fe(OH)3. [Fe3+] = 10-38 /1,6 10-11)3 = 2,4 10-6 mol/L potentiel pris par une lame de platine plongeant dans ce mélange: Fe3+ + 1 e- en équilibre avec Fe2+. E= E0 Fe3+/Fe2+ + 0,06 log [Fe3+] / [Fe2+] E=0,77 + 0,006 log (2,4 10-6 /10-3 )=0,77-0,16 = 0,61 V.
conservation de la matière : 10-3 = [Fe2+]+[FeY2-] donne [FeY2-] voisin 10-3 mol/L 10-3 = [Fe3+]+[FeY-] donne [FeY-] voisin 10-3 mol/L [Y4-]départ =0,01/0,1 = 0,1 mol/L [Y4-]fin voisin de 10-1 - 2*10-3 = 9,8 10-2 mol/L (1) s'écrit : [Fe2+] = 5 10-15 *10-3 / 9,8 10-2 =5,1 10-17 mol/L (2) s'écrit : [Fe3+] = 6 10-25 *10-3 / 9,8 10-2 =6,1 10-27 mol/L E= E0 Fe3+/Fe2+ + 0,06 log [Fe3+] / [Fe2+] E=0,77 + 0,006 log (6,1 10-27 /5,1 10-17 )=0,77-0,59 = 0,18 V.
carbone 12 : le noyau compte 6 protons et 6 neutrons carbone 13 : le noyau compte 6 protons et 7 neutrons carbone 14 : le noyau compte 6 protons et 8 neutrons ces 3 atomes sont isotopes : même numéro atomique mais des nombres de neutrons différents. le carbone 12 sert de référence. défaut de masse = somme des masses des 6 protons et des 6 neutrons - masse de l'atome de carbone 12 Dm = 6*1,00727 +6*1,00866 -12 =0,09558 uma soit 0,09558*1,66056 10-27 =1,586 10-26 kg énergie correspondante : 1,586 10-26 *(3108)² =1,427 10-9 J soit 1,427 10-9 / 1,6 10-11 =89,21 MeV énergie de liaisons par nucléons : 89,21 / 12 = 7,43 MeV par nucléons.
A0 / A = 8 ; ln (A0 / A )= ln 8 =2,079 loi de décroissance radioactive : ln (A0 / A ) = l t avec l T=ln2 = 0,69 et T=5400 ans l=1,2778 10-4 an-1 t = 2,079 /1,2778 10-4 = 16 270 ans.
|
||||||||||||||
|