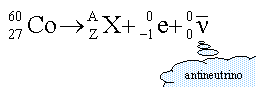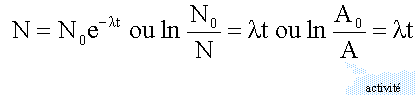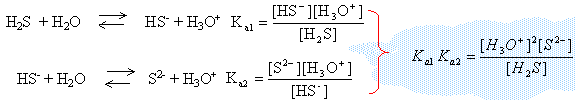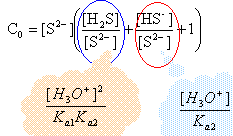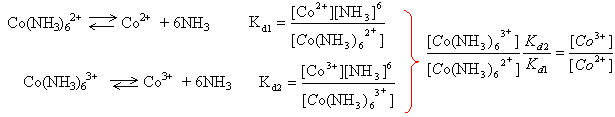|
l'élément cobalt bac 06 / 01
|
|||||||||||||
|
|
données :
Radioactivité. Le cobalt 60 est un radionucléide émetteur b-.
les ions du cobalt en solution : Données (à 25 °C) Constantes d'acidité des couples acide/base : H2S/HS- : pKa1 = 7,0 HS-/S2- : pKa2 = 13,0 Produits de solubilité Ks (MnS) = 3 10-10 Ks (CoS) = 4 10-21 Potentiels standard E°(Co3+/Co2+) = E°1 = + 1,84 V E°(O2/H2O)= + 1,23V Constantes de dissociation des complexes Co(NH3)62+ : Kdl = 4 10-5 Co(NH3)63+ : Kd2 = 6 10-36 (RT/F).ln(x) = 0,06 lg(x), en volt
Séparation des ions Co2+ d'un mélange, par précipitation de sulfures à pH contrôlé On considère que dans une solution aqueuse saturée en sulfure de dihydrogène (H2S), la concentration molaire en H2S, notée c0, est constante et égale à 0,10 mol.L-1, à 25 °C. Dans toute la question 1., on maintient la saturation en H2S et on augmente progressivement le pH à partir de pH = 0. Etude de la solution saturée de sulfure de dihydrogène.
Stabilité des ions Co3+ en solution aqueuse.
corrigé |
||||||||||||
|
27 électrons: 1s² (deux sur la première couche) 2s2 2p6 (huit sur la seconde couche) 3s2 3p6 3 d7 (15 sur la troisième couche) 4s² ( 2 sur la quatrième couche) le cobalt appartient à la première série des éléments de transition ( sous couche 3d incomplète et 2 électrons sur la sous couche 4s²) Co2+ : 1s² 2s2 2p6 3s2 3p6 3 d7 Co3+ : 1s² 2s2 2p6
3s2 3p6 3 d6
la radioactivité b- consiste en l'émission d'électron
conservation de la charge : 27 = Z -1 d'où Z = 28 en conséquence X est l'élément nickel conservation du nombre de nucléons : 60 = A soit dN le nombre de noyaux qui se désintègrent au cours du temps noté dt dN est proportionnel au nombre N de noyaux présents à la date t dN = - lNdt (1) l : constante radiactive caract"ristique de l'élément chimique le signe moins traduit la disparition des noyaux au cours du temps (1) s'écrit : N' + lN=0 équation différentielle du premier ordre dont les solutions sont de type :
la période radioactive T est la durée au bout de laquelle la moitié des noyaux initialement présents se sont désintégrés. ln 2 = lT avec ln2 = 0,693 en 1 an l'activité a diminuée de 12%: A = 0,88 A0 et t= 1 an ln (1 / 0,88 ) = l. d'où l = 0,1278 puis T =0,693 / 0,1278 =5,42 ans.
conservation de la matière (élément soufre) : C0 = [H2S]+[HS-]+[S2-]
on note h l'expression : [H3O+] C0 = [S2-] ( 1020 h² +1013 h +1) avec C0 = 0,1 mol/L
CoS en équilibre avec Co2+ + S2- avec 4 10-21 =[Co2+] [S2-] MnS en équilibre avec Mn2+ + S2- avec 3 10-10 =[Mn2+] [S2-] dés que le produit de solubilité est atteint, le sulfure métallique précipite. ici [Co2+]=[Mn2+]=0,01/0,2 =0,05 mol/L CoS précipite dés que [S2-] atteint la valeur 4 10-21/0,05= 8 10-20. par suite 0,1 = 8 10-20 ( 1020 h² +1013 h +1) 0,1 = 8 h² + 8 10-7 h + 8 10-20. les deux derniers termes sont négligeables d'où : h² voisin de 0,1 / 8 et h voisin de 0,111 soit pH = 0,95. le sulfure de cobalt précipite à partir de pH =0,95 MnS précipite dés que [S2-] atteint la valeur 3 10-10/0,05 = 6 10-9. par suite 0,1 = 6 10-9 ( 1020 h² +1013 h +1) 0,1 = 6 1011 h² + 6 104 h + 6 10-9. les deux derniers termes sont négligeables d'où : h² voisin de 0,1/ 6 1011 et h voisin de 4 10-7 soit pH = 6,4. le sulfure de manganèse précipite à partir de pH =6,4
Co3+ / Co2+ 1,84 V O2 / H2O 1,23 V lion cobalt constitue l'oxydant le plus fort et l'eau le réducteur le plus fort. il y a oxydation de l'eau en dioxygène et réduction de l'ion cobalt III en ion cobalt II. 4Co3+ + 6H2O donne 4Co2+ + O2 + 4H3O+. Co(NH3)62+ ion hexaamino cobalt II Co(NH3)63+ ion hexaamino cobalt III
Kd2/ Kd1 = 6 10-36 / 4 10-5= 1,5 10-31. un seul électron est mis en jeu : E1 = E01 + 0,06 ln [Co3+] / [Co2+] E1 = E01 + 0,06 ln ( [Co(NH3)63+] / [Co(NH3)62+] *1,5 10-31 ) E1 = E01 + 0,06 ln ( [Co(NH3)63+] / [Co(NH3)62+] +0,06 ln 1,5 10-31 ) E02 = E01 + 0,06 ln1,5 10-31 = E01 -1,85 =1,84-1,85 voisin de zéro
O2 / H2O 1,23 V Co(NH3)63+ / Co(NH3)62+ 0 V l'ion hexammino cobalt III est un oxydant plus faible que le dioxygène : cet ion ne peut réagir avec l'eau.
|
|||||||||||||
|